Pada awal reaksi, jumlah reaktan maksimal sementara jumlah produk minimal. Seiring berjalannya waktu, produk semakin bertambah karena reaktan berkurang. Laju reaksi diukur dalam satuan seperti mol per detik (M/s).
Baca juga: Energi Apa Saja yang Termasuk Energi Kinetik?
Faktor-faktor yang memengaruhi laju reaksi
Beberapa faktor-faktor yang memengaruhi laju reaksi, yaitu:
- Suhu
Energi kinetik meningkat dengan meningkatnya suhu. Oleh karena itu, jumlah molekul yang energinya lebih tinggi dari energi ambang juga meningkat. Akibatnya, jumlah tumbukan efektif antara molekul yang bereaksi juga meningkat.
Namun, laju reaksi tidak selalu sama dengan kenaikan suhu. Reaksi tertentu, seperti reaksi biologis yang dikatalisis oleh enzim, dapat diperlambat dengan menaikkan suhu karena enzim dapat kehilangan aktivitasnya.
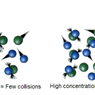
- Konsentrasi reaktan
Kecepatan reaksi berbanding lurus dengan konsentrasi reaktan. secara teoritis, laju reaksi harus meningkat dengan meningkatnya konsentrasi, karena laju berbanding lurus dengan frekuensi tumbukan. Laju reaksi menurun seiring waktu dengan berkurangnya konsentrasi reaktan.
- Luas permukaan
Kecepatan reaksi meningkat ketika luas permukaan reaktan padat meningkat. Permukaan padat dapat diperbaiki dengan mengubahnya menjadi bubuk halus.
Misalnya, reaksi antara seng dan asam klorida terjadi dalam hitungan detik ketika logam seng direduksi menjadi bubuk halus.
Tetapi reaksinya lebih lambat jika dalam bentuk kawat seng. Hal ini juga berlaku untuk katalis padat, yang biasanya digunakan dalam reaksi kimia sebagai bubuk halus. Misalnya, nikel yang digiling halus digunakan dalam hidrogenasi minyak mentah.
Baca juga: Energi Kinetik: Pengertian, Jenis, Contoh, dan Rumusnya
- Katalis
Katalis adalah zat yang mengubah kecepatan reaksi tanpa mengkonsumsinya atau menyebabkan perubahan kimia terjadi selama reaksi. Katalis meningkatkan laju reaksi dengan menyediakan jalur baru dengan energi aktivasi yang lebih rendah untuk reaksi.
Dalam reaksi reversibel, katalis menurunkan energi aktivasi reaksi maju dan reaksi balik pada laju yang sama dan membantu mencapai keseimbangan yang benar. Zat tertentu dapat memperlambat laju reaksi.
Ini biasanya disebut katalis negatif atau inhibitor. Mereka mencegah reaksi, membentuk kompleks yang relatif stabil dan membutuhkan lebih banyak energi. Dengan demikian, laju reaksi berkurang.
Reaksi kimia terjadi saat partikel bertumbukan dengan energi yang cukup, disebut energi aktivasi. Tidak semua unsur atau senyawa dapat bereaksi, hanya yang memiliki energi aktivasi yang mencukupi.
Katalis membantu mencapai energi aktivasi dengan menurunkannya. Katalis menyediakan jalur dengan energi aktivasi lebih rendah, meningkatkan kemungkinan tumbukan antar partikel dan meningkatkan laju reaksi.
Dengan demikian, penambahan katalis memfasilitasi reaksi dengan mengurangi energi aktivasi, memungkinkan lebih banyak partikel untuk bereaksi, dan meningkatkan laju reaksi.
Baca juga: Hukum Avogadro: Hukum Teori Kinetik Gas
Suka baca tulisan-tulisan seperti ini? Bantu kami meningkatkan kualitas dengan mengisi survei Manfaat Kolom Skola
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.