Hukum Boyle: Penemu, Bunyi, dan Persamaannya
KOMPAS.com – Gas adalah salah satu fasa zat yang sangat akrab dalam kehidupan manusia. Ada banyak hukum fisika dan kimia yang mendasari cara kerja gas, salah satunya hukum Boyle. Berikut adalah penjelasan tentang hukum Boyle!
Penemu hukum Boyle
Hukum Boyle adalah hukum yang mendasari sifat fisik gas, yaitu tekanan dan volume. Hukum Boyle dikemukakan oleh seorang filsuf, ahli kimia, fisikawan, dan penulis asal Irlandia bernama Robert Boyle pada tahun 1662.
Namun, hukum Boyle juga kerap disebut sebagai hukum Mariotte. Dilansir dari Thought Co, Mariotte adalah seorang fisikawan asal Perancis yang juga menemukan hukum Boyle secara independen pada tahun 1679.
Baca juga: Teori Kinetik Gas dan Hukumnya
Bunyi hukum Boyle
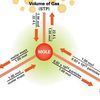
Dilansir dari NASA Glenn Research Center, Robert Boyle mempelajari hubungan antara tekanan (p) dan volume (V) dari gas yang dibatasi pada suhu konstan.
Boyle menemukan bahwa hasil kali dari tekanan dan volume, nilainya hampir konstan dan disebut sebagai konstanta gas ideal.
P x V = k
Dengan,
P: tekanan gas
V: volume gas
k: konstanta gas ideal
Partikel-partikel penyusun gas bergerak dengan bebas. Tubrukan antar partikel memberikan tekanan. Adapun, suhu memengaruhi energi kinetik dari partikel. Makin tinggi suhu, maka makin tinggi energi kinetiknya, mengakibatkan makin besar juga tekanan yang dihasilkan.
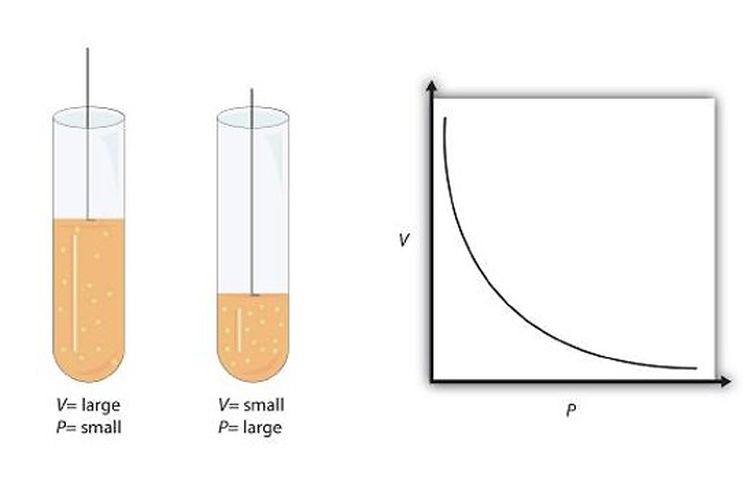
Bagaimana bunyi hukum Boyle? Dilansir dari Chemistry LibreTexts, hukum Boyle menyatakan bahwa dalam ruangan tertutup, volume sejumlah massa gas berubah berbanding terbalik dengan tekanan ketika suhunya konstan.
Baca juga: 4 Hukum Dasar Kimia
Persamaan hukum Boyle
Hukum Boyle digunakan untuk membandingkan kondisi gas saat tekanan dan volumenya berubah pada suhu yang konstan. Persamaan hukum Boyle dituliskan sebagai:

Dengan,
P1: tekanan gas pada kondisi pertama (N/m², Pa, atau atm)
P2: tekanan gas pada kondisi kedua (N/m², Pa, atau atm)
V1: volume gas pada kondisi pertama (m³)
V2: volume gas pada kondisi kedua (m³)
Persamaan hukum Boyle di atas menbandingkan dua kondisi gas. Pada suhu konstan, pengurangan volume akan menaikkan tekanan gas. Sedangkan, penambahan volume akan mengurangi tekanan gas.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.
-
![]()
Konsep Tekanan pada Peredaran Darah
-
![]()
Teori Kinetik Gas dan Hukumnya
-
![]()
Massa Molekul dan Gas Ideal
-
![]()
4 Hukum Dasar Kimia
-
![]()
Penentuan Volume Gas Pereaksi dan Hasil Reaksi
-
![]()
Mengapa Volume dan Bentuk Gas Berubah Sesuai Tempat
-
![]()
Faktor-faktor yang Memengaruhi Tekanan Zat Gas
-
![]()
Hukum Tekanan Parsial Gas Dalton
-
![]()
Hukum Avogadro: Hukum Teori Kinetik Gas