3 Konsep Dasar Reaksi Redoks
KOMPAS.com – Reaksi reduksi dan oksidasi (redoks) memiliki konsep yang didasari oleh transfer oksigen, elektron, dan bilangan oksidasi. 3 konsep dasar reaksi redoks adalah:
- Reaksi redoks berdasarkan transfer atom oksigen
- Reaksi redoks berdasarkan transfer elektron
- Reaksi redoks beradasarkan transfer hidrogen
Reaksi redoks berdasarkan transfer atom oksigen
Konsep dasar reaksi redoks yang pertama didasari oleh transfer oksigen. Di mana reaksi reodks terjadi karena pengikatan dan pelepasan oksigen dari dua zat yang bereaksi.
Reaksi oksidasi adalah reaksi pengikatan oksigen, sedangkan reaksi reduksi adalah pelepasan oksigen.
Baca juga: Reaksi Oksidasi Reduksi dan Konsep Redoks
Contoh reaksi redoks berdasarkan transfer atom oksigen adalah reaksi antara karbon dan merkuri (II) oksida sebagai berikut:
C + 2 HgO → CO2 + Hg
Dilansir dari Encyclopedia Britannica, karbon teroksidasi dengan menerima oksigen, sedangkan merkuri (II) oksida tereduksi karena kehilangan oksigen.
Reaksi redoks berdasarkan transfer elektron
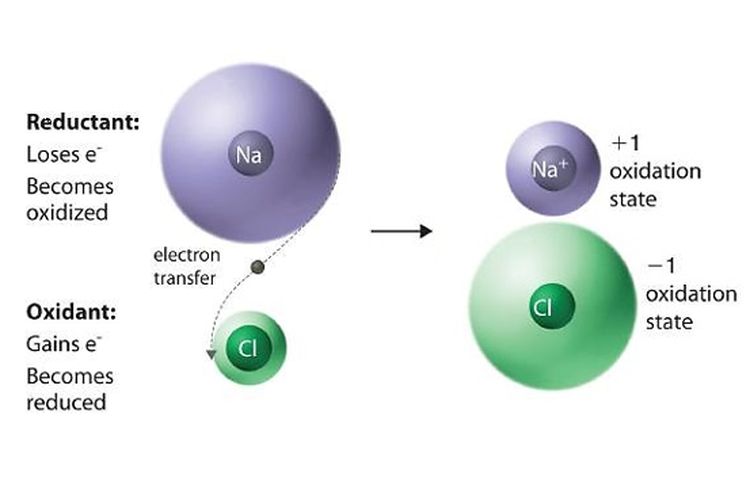
Konsep dasar reaksi redoks selanjutnya adalah reaksi redoks berdasarkan transfer elektron.
Dilansir dari Chemistry LibreTexts, reaksi oksidasi adalah reaksi pelepasan elektron sedangkan reaksi reduksi adalah mengikat atau mendapatkan elektron.
Baca juga: Contoh Reaksi Reduksi
Zat yang melepaskan elektron disebut dengan reduktor. Adapun, zat yang mengikat elektron disebut sebagai zat oksidator.
Contoh reaksi redoks berdasarkan transfer elektron adalah sebagai berikut:
Cu (s) + 2Ag+ (aq) → Cu 2+ (aq) + 2 Ag (s)
Di mana tembaga (Cu) teroksidasi karena kehilangan elektron, sedangkan perak (Ag) tereduksi karena mengika elektron.
Redoks berdasarkan transfer elektron dapat diidentifikasi melalui perubahan bilangan oksidasi zat-zat yang bereaksi.
Baca juga: Pengertian dan Cara Menyetarakan Reaksi Redoks
Dilansir dari Khan Academy, kenaikan bilangan oksidasi menandakan kehilangan elektron atau reaksi oksidasi.
Sedangkan, penurunan bilangan oksidasi menandakan pengikatan elektron atau reaksi reduksi.