Contoh sel volta dalam Kehidupan Sehari-hari
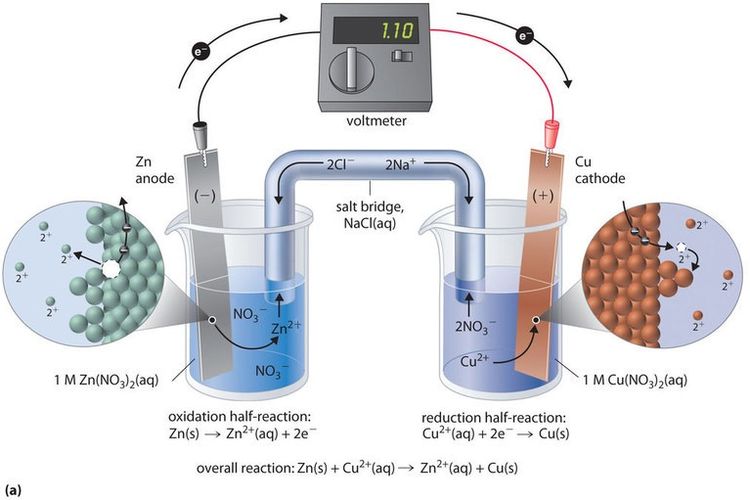
KOMPAS.com - Sel volta adalah kebalikan dari sel elektrolisis yang dapat mengubah energi listrik menjadi energi kimia. Selain itu juga merupakan arus listrik pertama yang ditemukan oleh seorang penemu bernama Galvani dan Volta sendiri.
Sel ini dapat menghasilkan listrik karena fungsi redoks yang terjadi secara spontan, artinya sel volta dapat mengubah energi kimia menjadi energi listrik.
Besarnya potensial arus yang dihasilkan oleh sel volta dapat ditentukan dengan menggunakan alat yang disebut voltmeter atau potensiometer.
Sel volta terdiri dari dua elektroda yang keduanya saling terhubung dan dapat menghasilkan listrik.
Baca juga: Sel Elektrokimia: Sel Volta dan Sel Elektrolisis
Selain itu juga dapat berfungsi sebagai jembatan garam ke larutan elektrolit tempat elektroda berada.
Sel volta telah diaplikasikan untuk beberapa alat yang biasa kita gunakan sehari-hari. Contoh sel volta dalam kehidupan sehari-hari adalah baterai, aki, dan sel bahan bakar.
Baterai
Baterai dibagi menjadi 2 bagian, yaitu baterai sekali pakai dan baterai isi ulang. Berikut jenis-jenis baterai, yaitu:
-
Baterai kering
Baterai kering ditemukan oleh Leclanche dan dipatenkan pada tahun 1866. Baterai kering setelah digunakan tidak dapat diisi kembali, sehingga disebut sel primer.
Baterai kering atau disebut sel Leclanche terdiri dari Zn sebagai anode, grafit (dalam larutan elektrolit MnO2, NH4CL, dan air) sebagai katode.
Reaksi redoks yang terjadi pada baterai kering adalah:
- Anode: Zn(s)→Zn2+(aq)2e-
- Katode: 2MnO2(S)+2NH4+(AQ)+2e-→Mn2O3(s)+H20(l)
Reaksi total: Zn(s)+2MnO2(s)=2NH4+(aq)→Zn2+(aq)+Mn2O3(s)+2NH3(aq)+H2O(l)
Baca juga: Baterai: Definisi, Jenis, Fungsi, dan Prinsipnya
-
Baterai alkalin
Baterai alkalin merupakan jeni baterai kering, hanya saja larutan NH4Cl pada baterai alkalin diganti dengan larutan KOH. Baterai alkalin dapat menhasilkan arus istrik lebih besar daya tahan baterai lebih lama dari baterai kering biasa. Reaksi yang terjadi adalah:
- Anode: Zn(s)+2OH-(aq)→Zn(OH)2(S)+2e-
- Katode: 2MnO2(s)+2H2O(l)+2e-→2Mn2O3(s)+2OH-(aq)
Reaksi total: Zn(s)+2MnO2(s)+2H2O(l)→Zn(OH)2(s)+2Mn2O3(s)
-
Baterai litium
Baterai litium merupakan jenis baterai yang dapat diisi ulang setelah pemakaian. Saat ini litium yang digunkan berupa ion litium.
Baca juga: Persamaan dan Perbedaan Baterai Kering dan Baterai Alkalin
Baterai litium dapat digunakan dengan memanfaatkan gerakan ion litium dari anode ke katode melalui suatu larutan elektrolit.