Sel Elektrokimia: Sel Volta dan Sel Elektrolisis
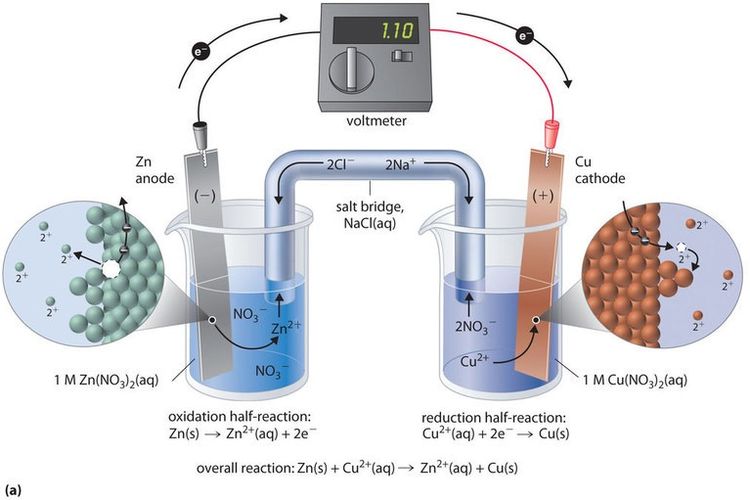
KOMPAS.com – Reaksi redoks (reduksi-oksidasi) adalah salah satu reaksi kimia yang penting bagi manusia. Reaksi redoks yang dapat menghasilkan arus listrik disebut dengan reaksi elektrokimia dalam sel volta.
Pengertian sel elektrokimia
Sel volta adalah salah satu jenis sel elektrokimia. Apa yang dimaksud dengan sel eletrokimia? Sel elektrokimia adalah tempat terjadinya reaksi elektrokimia atau reaksi perpindahan elektron yang diakibatkan arus listrik atau menghasilkan arus listrik.
Dilansir dari Encyclopedia Britannica, reaksi elektrokimia pertama kali dipelajari pada tahun 1796 oleh seorang ilmuan asal Italia bernama Alessandro Volta.
Kala itu, Volta membuat alat percobaan berupa pelat perak dan pelat seng yang dihubungkan oleh larutan elektrolit garam. Alat tersebut menunjukkan reaksi elektrokimia yang menghasilkan arus listrik melalui reaksi redoks.
Baca juga: Pengertian, Prinsip Kerja dan Stoikiometri Sel Elektrolisis
Alat percobaan Volta kemudian dinamakan sel elektrokimia. Sel elektrokimia Volta menjadi baterai pertama yang memproduksi listrik dalam sejarah umat manusia.
Sel elektrokimia terdiri dari dua buah elektroda konduktif, yaitu katoda dan anoda. Katoda akan terjadi reaksi reduksi, sedangkan pada anoda akan terjadi reaksi oksidasi.
Dilansir dari Chemistry LibreTexts, reaksi redoks mendorong perpindahan elektron dari zat yang teroksidasi ke zat yang direduksi.
Elektron dapat berpindah, karena sel elektrokimia menggunakan larutan elektrolit untuk menghantarkan elektron. Perpindahan elektron tersebut terjadi secara terus-menerus hingga menghasilkan arus listrik.
Baca juga: Pengertian dan Prinsip Kerja Sel Volta
Jenis-jenis sel elektrokimia
Secara garis besar, sel elektrokimia terbagi menjadi dua yaitu sel galvani atau sel volta dan juga sel elektrolisis.
Sel galvani atau sel volta
Sel galvani atau sel volta adalah sel elektrokimia yang menghasilkan arus listrik dari reaksi redoks yang spontan. Sel volta terdiri dari dua elektroda dalam elektrolit yang berbeda dan disambungkan oleh jembatan garam.
Dilansir dari Khan Academy, jembatan garam adalah elektrolit inert yang ion-ionnya akan berdifusi ke dalam sel yang terpisah untuk menyeimbangkan muatan.
Reaksi redoks pada sel volta, terjadi secara alami tanpa harus diberikan pemicu oleh manusia. Sel volta menghasilkan energi listrik dari reaksi redoks yang dipicu oleh energi potensial kimia.
Baca juga: Reaksi Oksidasi Reduksi dan Konsep Redoks
Reaksi redoks kemudian mengalirkan elektron dari anoda ke katode, dan menghasilkan arus listrik. Arus listrik yang dihasilkan sel volta adalah arus searah (DC).
Sel elektrolisis
Sel elektrolisis adalah sel elektrokimia yang menggunakan reaksi redoks tidak spontan. Sel elektrolisis menggunakan dua katoda dalam larutan elektrolit yang sama (tidak dipisahkan seperti pada sel volta).
Reaksi redoks pada sel elektrolisis tidak terjadi secara spontan, melainkan dipicu oleh perbedaan potensial listrik.
Anoda sel elektrolisis dihubungkan ke terminal positif, sedangkan katodanya dihubungkan ke terminal negatif. Arus listrik kemudian dialirkan ke dalam katoda.
Arus listrik yang mengalir kemudian memicu terjadinya reaksi redoks pada elektrodenya. Sehingga, sel elektrokimia mengubah energi listrik menjadi energi kimia.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.