Titrasi Asam Basa: Pengertian dan Prosedurnya
KOMPAS.com – Larutan adalah campuran dari zat pelarut dan zat terlarut. Konsentrasi larutan ditentukan oleh rasio antara zat terlarut dan zat pelarutnya. Konsentrasi larutan dapat ditentukan dengan beberapa cara, salah satunya adalah titrasi asam basa.
Pengertian titrasi asam basa
Dilansir dari Lumen Learning, titrasi asam basa adalah prsedur percobaan yang digunakan untuk menentukan konsentrasi suatu larutan dengan cara menetralkannya dengan asam atau basa yang konsentrasinya telah diketahui.
Pada dasarnya, titrasi adalah menambahkan larutan basa ke larutan asam (atau sebaliknya) hingga mencapai keseimbangan.
Baca juga: Teori Asam Basa: Pengertian Para Ahli dan Sifatnya
Prosedur titrasi asam basa
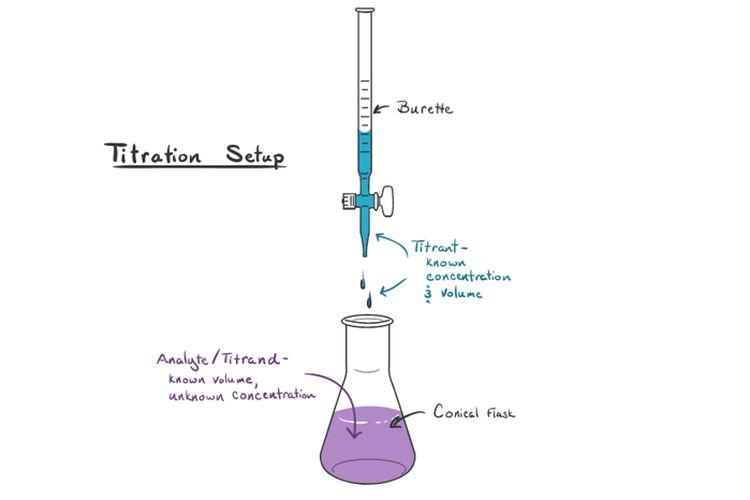
Bagaimana prosedur titrasi asam basa? Dalam melakukan titrasi, dibutuhkan alat berupa buret dan juga labu Erlenmeyer. Titrasi juga membutuhkan bahan berupa titran, analit, dan indikator asam basa.
- Analit atau titrat adalah larutan yang tidak diketahui konsentrasinya.
- Titran adalah larutan standar yang telah diketahui konsentrasinya.
- Indikator asam basa adalah zat yang mengalami perubahan warna ketika mendekati titik ekivalen.
Misalnya, larutan yang akan dicari konsentrasinya (analit) adalah larutan asam berupa asam klorida (HCl). Prosedur titrasinya adalah:
- Memasukkan titran ke dalam buret
- Memasukkan analit ke dalam labu Erlenmeyer
- Menambahkan beberapa tetes indikator asam basa ke dalam analit
- Meneteskan titran sedikit demi sedikit ke dalam analit
- Menghentikan titrasi ketika warna analit berubah
- Mencatat volume titran yang masuk ke dalam analit
Baca juga: Sifat Koligatif Larutan: Perbedaan Molaritas dan Molalitas
Warna analit yang berubah merupakan efek dari penambahan indikator asam basa. Warna yang berubah menandakan bahwa titrasi telah mencapai titik ekivalennya.
Dilansir dari Khan Academy, titik ekivalen adalah titik titrasi di mana jumlah titran yang ditambahkan cukup untk menetralkan larutan analit secara sempurna. Pada titik ekivalen inilah asam basa habis bereaksi sehingga mol titran dan analit adalah sama.
Sehingga, didapatkan rumus perhitungan konsentrasi titrasi asam basa sebagai berikut:
Ma x Va x a = Mb x Vb x b
Dengan,
Ma: molaritas larutan asam (M)
Mb: molaritas larutan basa (M)
Va: volume larutan asam (L atau mL)
Vb: volume larutan basa (L atau mL)
a: valensi larutan asam
b: valensi larutan basa
Jika yang ditrasi (analit) adalah HCL, maka titrannya adalah larutan basa (biasanya NaOH). Sehingga, yang dimaksud dengan volume larutan basa (Vb) adalah jumlah volume titran yang masuk ke dalam analit hingga titik ekivalen dicapai.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.
-
![]()
Menentukan Pasangan Asam Basa Konjugasi
-
![]()
Larutan Asam, Basa dan Garam
-
![]()
Soal UAS Kimia: Prinsip Molalitas dan Molaritas
-
![]()
Sifat Koligatif Larutan: Perbedaan Molaritas dan Molalitas
-
![]()
Contoh Soal Sifat Koligatif
-
![]()
Sifat Koligatif Larutan Non-Elektrolit
-
![]()
Teori Asam Basa: Pengertian Para Ahli dan Sifatnya
-
![]()
Daftar Rumus Kimia Asam
-
![]()
Penyebab Buah Manis dan Asam
-
![]()
Asam Traumalin: Fungsi dan Perannya
-
![]()
Apa Itu Hujan Asam?