Baca berita tanpa iklan. Gabung Kompas.com+
Teori Asam Basa Arrhenius dan Keterbatasannya
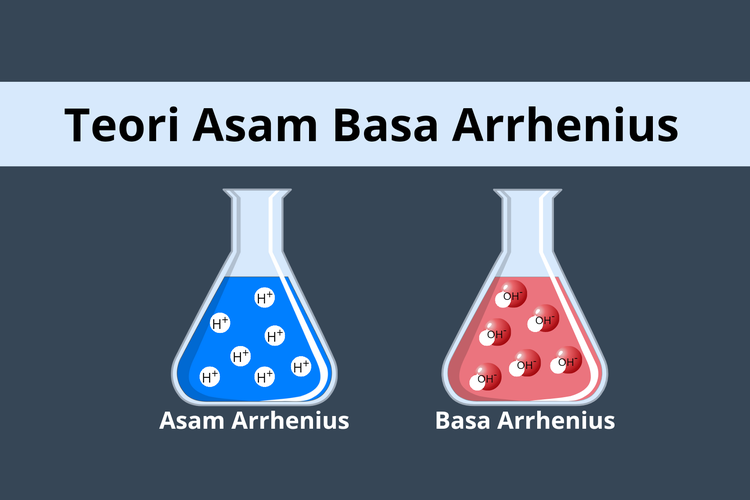
Teori asam basa Arrhenius
Cari soal sekolah lainnya
Tidak bisa menjelaskan perbedaan jenis pelarut
Kelemahan teori asam basa Arrhenius selanjutnya adalah tidak bisa menjelaskan pengaruh perbedaan jenis pelarut pada zat asam, maupun basa.
Misalnya, asam klorida (HCl) yang berperilaku sebagai asam kuat dalam air. Namun, berperilaku sebagai asam lemah dalam benzena.
Tidak berlaku pada senyawa yang tidak memiliki ion hidroksida dan hidrogen
Teori asam basa Arrhenius tidak dapat mengklasifikasikan senyawa yang tidak memiliki ion hidroksida (OH-) dan ion hidrogen (H+).
Misalnya, tidak bisa mengidentifikasi senyawa asam yang tidak memiliki ion hidrogen seperti SO2, SO3, CO3, AlCl3, dan CuSo4.
Teori asam basa Arrhenius juga tidak bisa mengidentifikasi senyawa basa yang tidak memiliki ion hidroksida seperti CaO, MgO, NH3, dan Na2CO3.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.
Video rekomendasi
Video lainnya
Cari soal sekolah lainnya
Rekomendasi untuk anda