Teori Asam Basa: Pengertian Para Ahli dan Sifatnya

Adapun asam krlorida adalah yang mendonorkan proton karena melepaskan proton dan berubah menjadi muatan negatif. Sehingga asam krlorida (HCl) adalah asam dan ion klorida (CL-) adalah basa konjugasinya.
Adapun perbedaan asam lemah dan kuat pada teori asam basa Bronsted-Lowry dapat dilihat dari tingkat disosiasi zat dalam laruan.
Dilansir dari Chemistry Libretexts, senyawa asam kuat akan terdisosiasi, terurai menjadi ion H+ dalam larutan secara sempurna.
Sedangkan asam lemah tidak akan terdisosiasi secara sempurna dalam larutan. Hal tersebut juga berlaku pada penentuan basa kuat.
Baca juga: Daftar Rumus Kimia Asam
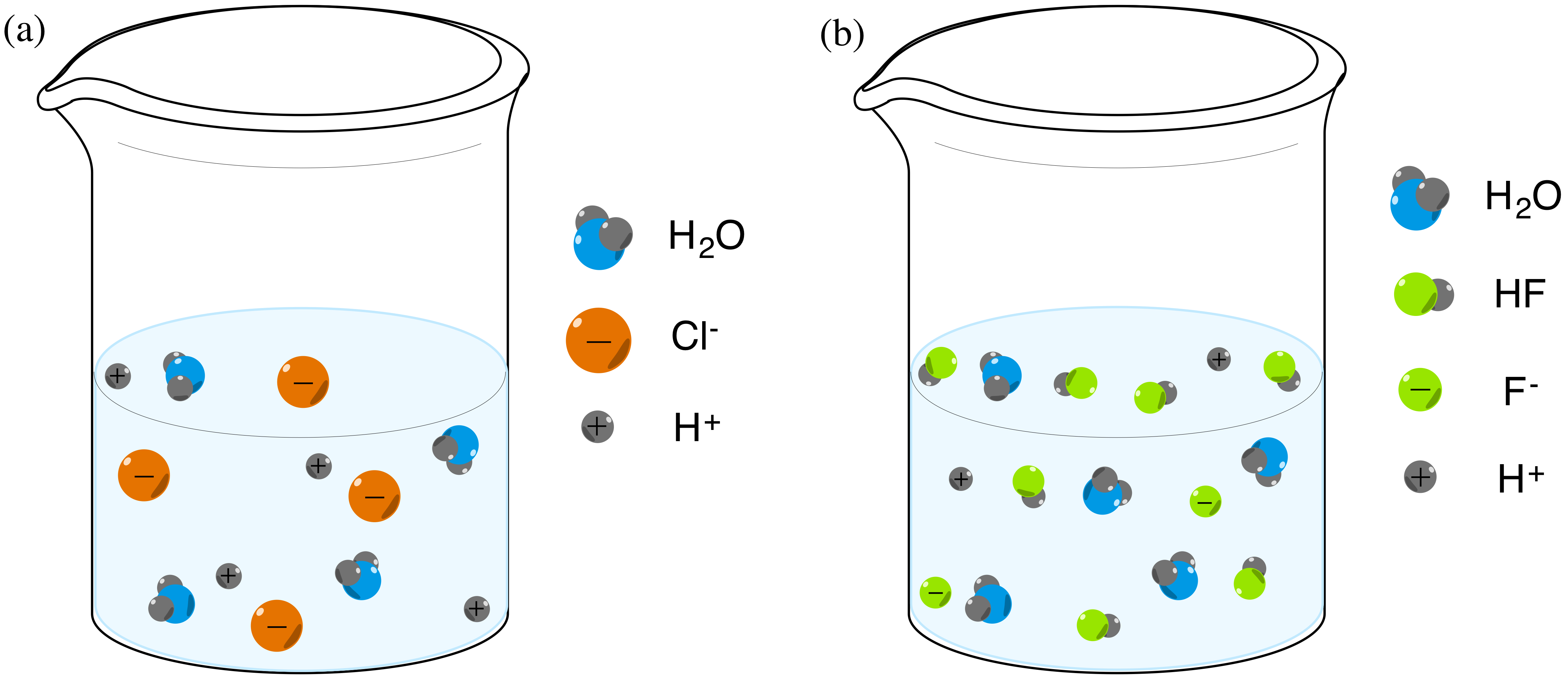 (1) Asam kuat HCl yang terdisosiasi secara sempurna dalam air dan (2) asam lemah HF yang tidak terdisosiasi secara sempurna dalam air
(1) Asam kuat HCl yang terdisosiasi secara sempurna dalam air dan (2) asam lemah HF yang tidak terdisosiasi secara sempurna dalam air
Contoh asam kuat adalah asam klorida (HCl), asam bromide (HBr), asam iodida (HI), asam nitrat (HNO3), dan asam sulfat (H2SO4). Contoh asam lemah adalah asam fluorida (HF), hidrogen sulfide (H2S), hidrogen sianida (HCN), dan asam format (HCOOH).
Contoh basa kuat adalah natrium hidroksida (NaOH), litium hidroksida (LiOH), kalium hidroksida (KOH), rubidium hidroksida (RbOH), dan hidroksida lain dari golongan I (logam alkali) juga golongan II (logam alkali tanah).
Adapun contoh basa lemah adalah ammonia (NH3), piridin (C5H5N), kelompok amino (NH2), dan senyawa metil (CH3).
Teori Asam Basa Lewis
Tidak seperti dua teori sebelumnya, teori asam basa Lewis tidak menyebutkan tentang atom hidrogen. Teori asam basa Lewis dikemukakan oleh Gilbert Newton Lewis pada tahun 1923 dan merupakan pengembangan dari teori Bronsted-Lowry.
Dilansir dari Purdue University College of Science, asam Lewis adalah zat apapun yang menjadi akseptor pasangan elektron. Maka basa adalah kebalikannya, yaitu zat yang menjadi donor (penyumbang) pasangan elektron.
Sehingga reaksi antara asam dan basa menurut Lewis adalah reaksi perpindahan (transfer) elektron dari zat bersifat basa ke zat yang bersifat asam.
Baca juga: Apa Itu Hujan Asam?
Misalkan reaksi yang terjadi antara ammonia (NH3) dengan boron trifluorida (BF3) yang tidak terjadi perpindahan proton (ion hidrogen) di dalamnya.
Senyawa BF3 tidak memenuhi aturan oktet karena tidak semua kulitnya terisi. BF3 hanya memiliki 6 buah elektron valensi, sehingga kekurangan 2 buah elektron valensi untuk mencapai keadaan stabil sesuai aturan oktet.
 Reaksi antara ammonia dengan boron trifluorida
Reaksi antara ammonia dengan boron trifluorida
Hal ini membuat NH3 yang memiliki pasangan elektron bebas berikatan dengan BF3. Sepasang elektron bebas NH3 kemudian mengisi orbital yang kosong pada BF3 dan membentuk kompleks asam-basa dengan ikatan kovalen.
NH3 yang menyumbangkan (donor) pasangan elektron disebut dengan basa Lewis, sedangkan BF3 yang menerima donor (akseptor) pasangan elektron disebut dengan asam Lewis.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.