Pengertian dan Cara Menyetarakan Reaksi Redoks

KOMPAS.com - Reaksi redoks adalah singkatan dari reaksi reduksi dan oksidasi yang berlangsung pada proses elektrokimia. Dilansir dari Encyclopaedia Britannica, reaksi redoks berkaitan dengan pelepasan atau pengikatan elektron, atom oksigen, dan atom hidrogen.
Pengertian Reduksi
Reduksi adalah reaksi yang mengalami penurunan bilangan oksidasi dan kenaikan elektron. Dapat dikatakan bahwa reduksi adalah reaksi dimana suatu zat kehilangan oksigen.
Pengertian Oksidasi
Oksidasi adalah reaksi yang mengalami peningkatan bilangan oksidasi dan penurunan elektron. Dapat dikatakan bahwa oksidasi adalah reaksi dimana suatu zat mengikat oksigen.
 Reaksi redoks
Reaksi redoks
Besi (III) oksida (Fe2O3) mengalami reduksi karena kehilangan atom oksigen dan berubah menjadi besi (2Fe). Adapun karbon monoksida (3CO) mengalami reaksi oksidasi karena mengikat atom oksigen dan berubah menjadi karbon dioksida (3CO2).
Baca juga: Faktor-Faktor yang Memengaruhi Laju Reaksi
Untuk menyetarakan reaksi redoks, dapat dilakukan dua cara yaitu cara bilangan oksidasi dan cara setengah reaksi.
Cara Bilangan Oksidasi
Bilangan oksidasi atau biloks adalah bilangan yang menyatakan jumlah elektron dalam suatu atom. Penyetaraan reaksi redoks dilakukan dengan cara menyetarakan elektron yang dilepaskan oksidator dan elektron yang diikat reduktor.
Dilansir dari Chemistry Washington University, bilangan oksidasi dapat ditentukan dengan cara berikut:
- Atom dalam bentuk unsur bebas memiliki nilai oksidasi 0, contohnya adalah Fe, O2, H2, dan Mg.
- Bilangan oksidasi atom sesuai dengan muatan ionnya. Contohnya Na+ memiliki bilangan oksidasi +1 dan Fe2+ memiliki bilangan oksidasi +2.
- Unsur fluor (F) memiliki bilangan oksidasi yang selalu sama yaitu -1
- Bilangan oksidasi hidrogen yang berikatan dengan logam adalah +1, dan yang berikatan dengan non-logam bilangan oksidasinya -1.
- Bilangan oksidasi logam sesuai dengan golongannya. Contohnya Mg memiliki bilangan oksidasi +2 karena berada pada golongan IIA.
- Bilangan oksidasi unsur golongan VIA biner adalah -2, sedangkan bilangan oksidasi unsur golongan VIIA biner adalah -1.
Baca juga: Persamaan Laju Reaksi
 Ilustrasi stres oksidasi
Ilustrasi stres oksidasiCara Setengah Reaksi
Cara setengah reaksi adalah cara penyetaraan reaksi redoks dengan cara membagi reaksi menjadi reaksi reduksi dan oksidasi. Seimbangkanlah reaksi redoks berikut ini:
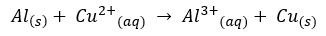 Reaksi resoks tembaga
Reaksi resoks tembaga
Reaksi redoks tersebut dibagi menjadi setengah reaksi reduksi dan setengah reaksi oksidasi.
Reaksi reduksi:
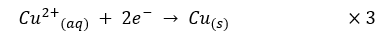 Reaksi reduksi tembaga
Reaksi reduksi tembaga
Reaksi oksidasi:
 Reaksi oksidasi alumunium
Reaksi oksidasi alumunium
Reaksi reduksi dan oksidasi masing-masing dikalikan 3 dan 2 untuk menyeimbangkan muatannya. Setelah disembimbangkan, kedua reaksi dapat dijumlahkan untuk menghasilkan reaksi redoks yang setimbang seperti berikut:
 Penyetaraan reaksi redoks
Penyetaraan reaksi redoks
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.


































































