Molalitas: Pengertian, Satuan, Rumus, dan Contoh Soal Menghitungnya

KOMPAS.com – Larutan memiliki beberapa jenis sifat koligatif, salah satunya adalah molalitas. Apa yang dimaksud dengan molelitas dan bagaiamana rumus molalitas? Berikut adalah penjelasannya!
Pengertian molalitas
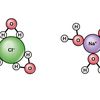
Dilansir dari Chemistry LibreTexts, molalitas adalah cara menyatakan konsentrasi larutan. Molalitas merupakan jumlah mol suatu zat terlarut dalam satu kilogram atau 1.000 gram pelarut.
Tidak seperti molaritas yang bergantung pada ukuran liter larutan, molalitas bergantung pada massa larutan.
Baca juga: Sifat Koligatif Larutan: Perbedaan Molaritas dan Molalitas
Sehingga, molalitas lebih sering digunakan dalam sistem yang mengalami perubahan suhu atau tekanan.
Dilansir dari Thought Co, molalitas dapat digunakan ketika menentukan titik didih, titik leleh, juga ketika bekerja dengan sifat koligatif larutan seperti kenaikan titik didih dan penurunan titik beku.
Satuan molalitas
Molalitas adalah besaran turunan yang memiliki satuan. Dilansir dari ChemistryGod, satuan standar molalitas adalah mol per kilogram (mol/kg) atau kerap disebut sebagai molal.
Molal biasanya dilambangkan dengan huruf “m”. Misalnya, molalitas suatu larutan adalah 12 mol/kg, maka dapat dinyatakan sebagai 12 molal atau 12 m.
Baca juga: Soal UAS Kimia: Prinsip Molalitas dan Molaritas
Rumus molalitas
Seperti yang telah dikatakan sebelumnya, molalitas adalah jumlah mol zat terlarut dalam 1.000 gram pelarut. Maka, rumus molalitas adalah:
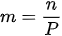
Dengan,
m: molalitas larutan (molal atau mol/kg)
n: jumlah mol zat (mol)
p: massa pelarut (kg)
atau
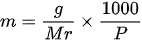
Dengan,
m: molalitas (molal atau mol/kg)
g: massa zat terlarut (g)
Mr: massa relatif zat terlarut (g/mol)
P: massa pelarut (g)
Baca juga: Larutan Asam, Basa dan Garam
Contoh soal menghitung molalitas
Jika diketahui massa molekul relatif (Mr) fruktosa adalah 180, maka molalitas larutan fruktosa 10% adalah …
Jawaban:
Untuk menjawab soal tersebut, pertama-tama kita harus menghitung massa pelarutnya.
Larutan fruktosa 10% artinya adalah 10 bagian frukstosa dari 100 bagian larutan. Sederhanya, suatu larutan terbentuk dari 10 bagian fruktosa yang terlarut dalam 90 bagian air.
Misalnya, massa larutan adalah 100 gram, maka berat fruktosa adalah 10 gram dan berat air adalah 90 gram.
Setelah mengetahui massa pelarutnya, kita dapat menghitung molalitasnya.

Sehingga, molalitas larutan fruktosa 10% adalah 0,62 molal.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.
-
![]()
Pengertian dan Contoh Soal Fraksi Mol
-
![]()
Konsep Mol dan Tetapan Avogadro
-
![]()
Sifat Koligatif Larutan: Perbedaan Molaritas dan Molalitas
-
![]()
Soal UAS Kimia: Prinsip Molalitas dan Molaritas
-
![]()
Contoh Larutan Elektrolit dalam Kehidupan Sehari-hari
-
![]()
Mengapa Larutan Elektrolit dapat Menghantarkan Listrik?
-
![]()
Fungsi Larutan Penyangga dalam Tubuh
-
![]()
Contoh Larutan Elektrolit Kuat dan Larutan Elektrolit Lemah
-
![]()
Larutan Penyangga: Pengertian dan Jenisnya