Apa itu Termokimia?
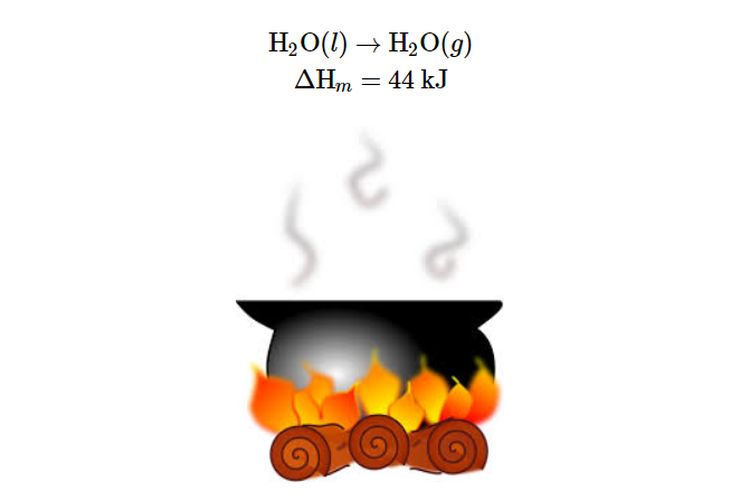
KOMPAS.com – Ilmu kimia dibagi menjadi beberapa bidang, salah satunya termokimia. Apa itu termokimia? Untuk mengetahuinya, simaklah penjelasan berikut ini!
Pengertian termokimia
Dilansir dari A Level Chemistry Revision, termokimia adalah cabang ilmu kimia yang mempelajari perubahan energi yang terjadi selama reaksi.
Dalam reaksi kimia atau perubahan kimia, terjadi perubahan reaktan menjadi produk. Dalam prosesnya, energi selama reaksi berubah-ubah.
Energi yang dimaksud adalah energi panas atau kalor.
Baca juga: Perbedaan Suhu dan Kalor
Hubungan termokimia dengan termodinamika
Istilah termokimia terdengar mirip dengan termodinamika, karena keduanya saling berhubungan.
Termokimia merupakan cabang ilmu termodinamika. Dalam termodinamika ada yang dinamakan hukum pertama termodinamika.
Hukum pertama termodinamika menyatakan bahwa energi di alam semesta adalah konstan.
Adapun, perubahan yang terjadi dikarenakan ada jumlah panas yang dimasukkan atau dikeluarkan oleh sistem.
Dilansir dari Chemistry Talk, perubahan panas tersebutlah yang menjadi studi termokimia.
Baca juga: Hukum 1 Termodinamika: Bunyi, Persamaan, dan Konsekuensinya
Sistem dan lingkungan dalam termokimia
Dalam termokimia, ada yang disebut sebagai sistem dan lingkungan.
Sistem adalah tempat berlangsungnya suatu reaksi kimia yang menyebabkan perubahan energi. Sedangkan lingkungan adalah segala sesuatu di luar sistem.
Ada tiga jenis sistem dalam termokimia, yaitu sistem terbuka, sistem tertuto, dan sistem terisolasi.
- Sistem terbuka adalah sistem termokimia yang memungkinkan pertukaran energi dan massa dengan lingkungannya.
- Sistem tertutup adalah sistem termokimia yang hanya memungkinkan pertukaran energi tanpa adanya pertukaran massa.
- Sistem terisolasi adalah sistem termokimia yang tidak memungkinkan pertukaran massa maupun energi dengan lingkungannya.
Baca juga: Sistem Termodinamika: Terbuka, Tertutup, dan Terisolasi
Persamaan termokimia
Persamaan termokimia sedikit berbeda dengan persamaan kimia biasa. Di mana persamaan termokimia terdiri dari reaktan, produk, dan juga perubahan entalpi.
Dilansir dari Chemistry LibreTexts, perubahan entalpi (ΔH) memberi tahu jumlah energi reaksi dan apakah energi panas dilepaskan atau diserap selama reaksi.
Jika perubahan entalpi bernilai positif, berarti energi panas diserap oleh reaksi. Sehingga, reaksi tergolong reaksi endodermik.
Sedangkan, jika perubahan entalpi bernilai negatif, berarti energi panas dilepaskan oleh sistem ke lingkungan. Sehingga, reaksinya tergolong reaksi eksotermik.
Baca juga: Perbedaan Reaksi Endoterm dan Eksoterm
Contoh persamaan termokimia adalah:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O(l) ΔH = -890 Kj
Artinya, reaksi tersebut adalah reaksi eksotermik yang melepaskan kalor ke lingkungannya.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.