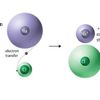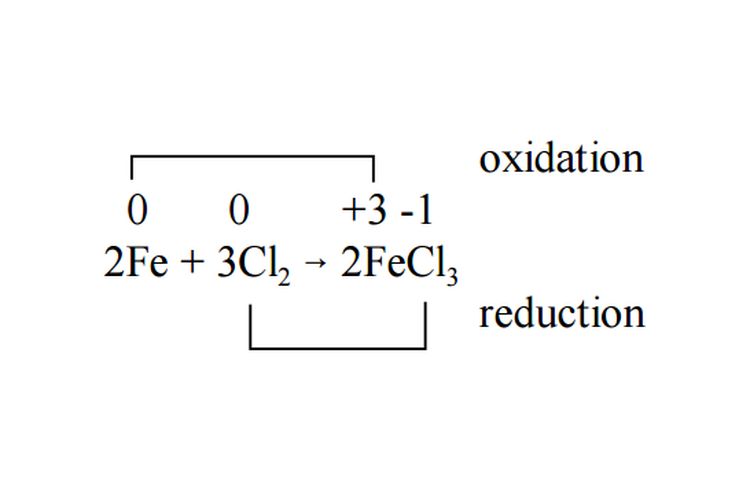
KOMPAS.com - Biloks atau bilangan oksidasi unsur adalah bilangan yang menunjukkan sumbangan muatan suatu atom unsur pada molekul atau ion yang dibentuknya.
Bilangan oksidasi suatu unsur pada suatu senyawa umumnya sama dengan jumlah elektron yang dilepas atau dipasangkan oleh satu atom unsur pada senyawa tersebut.
Unsur yang melepas elektron memiliki bilangan oksidasi bertanda positif, sedangkan yang menangkap elektron bertanda negatif.
Bilangan oksidasi digunakan untuk mengekspresikan persamaan reaksi setengah yang terjadi dalam reaksi oksidasi dan reduksi.
Baca juga: Apa yang Dimaksud dengan Bilangan Oksidasi?
Penggolongan reaksi berdasarkan perubahan bilangan oksidasi terbagi menjadi 4, yaitu:
- Reaksi bukan redoks
- Reaksi redoks
- Reaksi autoredoks (reaksi disproporsionasi)
- Reaksi konproporsionasi.
Reaksi bukan redoks
Pada reaksi bukan redoks, bilangan oksidasi setiap unsur dalam reaksi tidak berubah (tetap).
Contoh:
CaO + 2HCl → CaCl + H2O
+2-2 +1-1 +2-1 +1-2
Reaksi di atas merupakan bukan reaksi redoks, karena bilangan oksidasi setiap unsur sebelum dan sesudah reaksi tidak berubah (tetap).
Baca juga: 3 Konsep Dasar Reaksi Redoks
Reaksi redoks
Pada reaksi redoks terjadi peningkatan dan penurunan bilangan oksidasi pada unsur yang terlibat dalam reaksi.
Contoh:
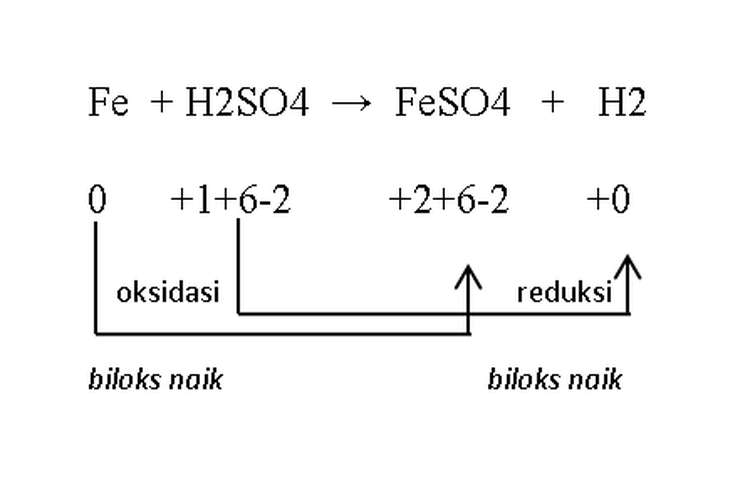 reaksi redoks
reaksi redoks- Oksidator: H2SO4
- Reduktor: Fe
- Hasil reduksi: H2
- Hasil oksidasi: FeSO4
Baca juga: Apa yang Dimaksud dengan Reduktor?
Fe (reduktor) mengalami oksidasi, bilangan oksidasinya berubah dari 0 menjadi +2.
Sedangkan H2SO4 (oksidator) mengalami reduksi, bilangan oksidasinya berubah dari +1 menjadi 0.
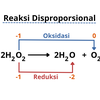
Reaksi autoredoks (reaksi disproporsionasi)
Reaksi ini merupakan reaksi yang oksidator maupun reduktornya merupakan zat yang sama.
Contoh:
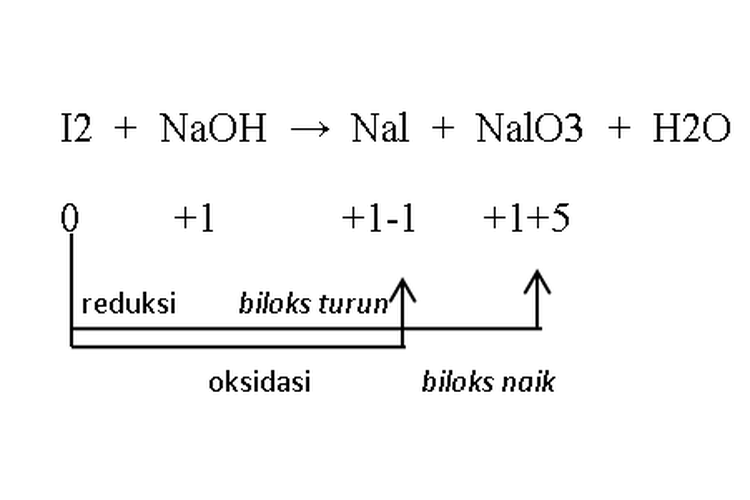 Reaksi Autoredoks
Reaksi Autoredoks- Oksidator: I2
- Reduktor: I2
- Hasil reduksi: NaI
- Hasil oksidasi: NaIO3
I2 berperan sebagai oksidator sekaligus reduktor sehingga reaksi tersebut disebut reaksi autoredoks.
Baca juga: Reaksi Disproporsionasi: Pengertian, Syarat, dan Contohnya
Reaksi konproporsionasi
Reaksi konproporsionasi merupakan kebalikan dari reaksi disproporsionasi, yaitu reaksi redoks yang hasil oksidasi dan hasil reduksinya merupakan zat yang sama.
Contoh:
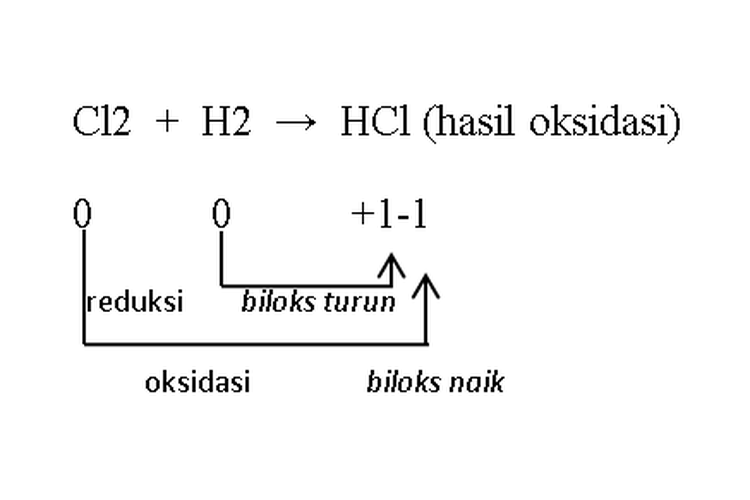 Reaksi Konproporsionasi
Reaksi KonproporsionasiReaksi di atas hasil oksidasi dan hasil reduksinya merupakan zat yang sama, yaitu asam klorida (HCl), sehingga reaksi di atas disebut reaksi konproporsionasi.
Baca juga: Reaksi Oksidasi Reduksi dan Konsep Redoks
Referensi:
- Sulastri, dan teman-teman. Kimia Dasar. 2017. Aceh: Syiah Kuala University Press.
- Sandra, Lovi dan teman-teman. Kimia Dasar. 2022. Padang: Global Eksekutif Teknologi.