Perbedaan Sel Volta dan Sel Elektrolisis
KOMPAS.com – Sel elektrokimia terbagi menjadi dua jenis, yaitu sel volta dan sel elektrolisis. Tahukah kamu, apa perbedaan sel volta dan sel elektrolisis? Untuk mengetahuinya, simaklah penjelasan berikut ini!
Spontanitas reaksi
Sel volta dan sel elektrolisis, keduanya merupakan reaksi redoks yang memiliki perbedaan.
Di mana reaksi redoks sel volta berlangsung secara spontan sedangkan, reaksi redoks sel elektrokimia tidak.
Hal tersebut terjadi karena sel volta menggunakan energi kimia yang ada. Sedangkan, sel elektrokimia memerlukan energi listrik untuk memicu terjadi reaksi redoks.
Baca juga: 3 Konsep Dasar Reaksi Redoks
Konversi energi
Perbedaan sel volta dan sel elektrolisis adalah konversi atau perubahan energinya.
Dilansir dari Purdue University, sel volta menggunakan reaksi redoks spontan untuk mengubah energi kimia untuk menghasilkan energi listrik.
Sedangkan, sel elektrokimia menggunakan reaksi redoks tidak spontan yang mengubah energi listrik untuk menghasilkan energi kimia
Baca juga: Contoh Perubahan Energi Listrik menjadi Bentuk Energi Lainnya
Logam elektroda
Perbedaan sel volta dan sel elektrolisis selanjutnya adalah logam elektroda yang digunakan.
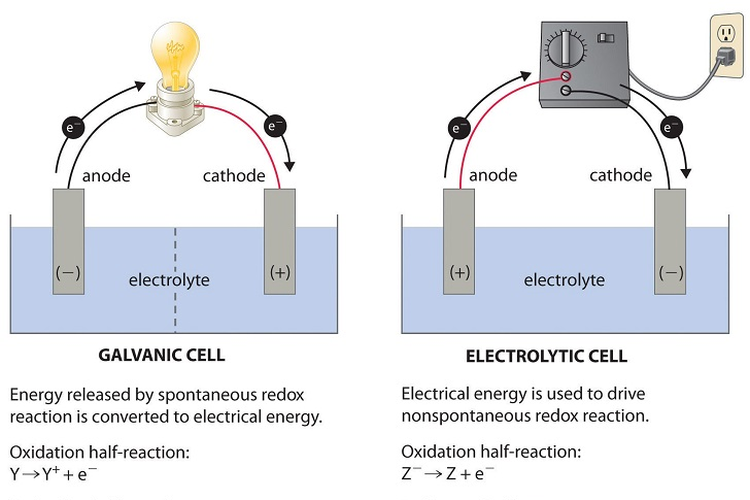
Sel volta menggunakan dua elektroda (anoda dan katoda) yang terbuat dari logam yang berbeda.
Di mana satu elektroda lebih reaktif terhadap larutan elektrolit dibanding dengan elektroda lainnya.
Adapun sebagaimana dilansir dari Science Struck, sel elektrolisis mengguanakan dua elektroda dari logam inert yang sama. Logam tersebut biasanya adalah grafit atau platinum.
Baca juga: Sel Elektrokimia: Sel Volta dan Sel Elektrolisis
Muatan elektrodanya
Perbedaan sel volta dan sel elektrolisis adalah muatan elektrodanya.
Dilansir dari Chemistry LibreTexts, alam sel volta anoda adalah elektroda negatif yang mengalami reaksi oksidasi dan katoda adalah elektroda positif yang mengalami reaksi reduksi.
Sedangkan, dalam sel elektrolisis anoda adalah elektroda positif yang mengalami oksidasi dan katoda adalah elektroda negatif yang mengalami reduksi.
Baca juga: Pengertian dan Prinsip Kerja Sel Volta
Wadah cairan elektrolitnya
Perbedaan sel volta dan sel elektrolisis selanjutnya adalah wadah cairan elektrolitnya.
Dalam sel volta, elektrolit cair pada katoda dan anoda dipisahkan dalam wadah yang berbeda. Kedua cairan tersebut kemudian dihubungkan melalui jembatan garam.
Sedangkan dalam sel elektrolisis, cairan elektrolit hanya ditempatkan dalam satu wadah yang sama tanpa perlu dipisahkan.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.