BPOM Terbitkan Izin Penggunaan Darurat Vaksin Covid-19 Sinovac, Apa Maksudnya dan Berlaku sampai Kapan?

KOMPAS.com – Badan Pengawas Obat dan Makanan (BPOM) telah menerbitkan izin penggunaan darurat untuk vaksin Sinovac pada 11 Januari 2021.
Adanya pemberian izin dari BPOM ini, maka vaksin Sinovac telah mendapat izin untuk digunakan dalam vaksinasi.
Baca juga: Pemerintah Gratiskan Vaksin Covid-19, Mengapa Diberikan Lewat Suntikan?
"Pada hari ini, Senin tanggal 11 Januari 2021, Badan POM memberikan persetujuan penggunaan dalam kondisi emergency, emergency use authorization untuk vaksin Covid-19 yang pertama kali kepada vaksin Corona vax produksi Sinovac Biotech Incorporated yang bekerja sama dengan PT Bio Farma," kata Kepala BPOM Penny Lukito dikutip dari keterangan resmi BPOM, Senin (11/1/2021).
Penny menyampaikan, penerapan EUA dilakukan oleh semua otoritas regulatori obat di seluruh dunia untuk mengatasi pandemi Covid-19.
“Secara internasional, kebijakan EUA ini selaras dengan panduan WHO, yang menyebutkan bahwa EUA dapat ditetapkan dengan beberapa kriteria," ungkapnya.
Baca juga: Mengenal Vaksin Sinovac yang Telah Tiba di Indonesia
Lantas apa yang dimaksud dengan izin penggunaan darurat?
Penjelasan mengenai hal tersebut terlampir dalam Keputusan Kepala Badan Pengawas Obat dan Makanan (BPOM) RI Nomor HK.02.02.1.2.1.1.20.1126 Tahun 2020 tentang Petunjuk Teknis Pelaksanaan Persetujuan Darurat yang ditandatangani Kepala BPOM Penny K Lukito.
Dalam surat keputusan tersebut disebutkan Izin Penggunaan Darurat atau Emergency Use Authorizetion (EUA) adalah persetujuan penggunaan obat selama kondisi kedaruratan kesehatan masyarakat untuk obat yang belum mendapatkan izin edar atau obat yang telah mendapatkan izin edar tetapi dengan indikasi penggunaan yang berbeda untuk kondisi kedaruratan kesehatan masyarakat.
Baca juga: Melihat Efektivitas Vaksin Covid-19 yang Telah Diumumkan, dari Pfizer-BioNTech hingga Sinovac
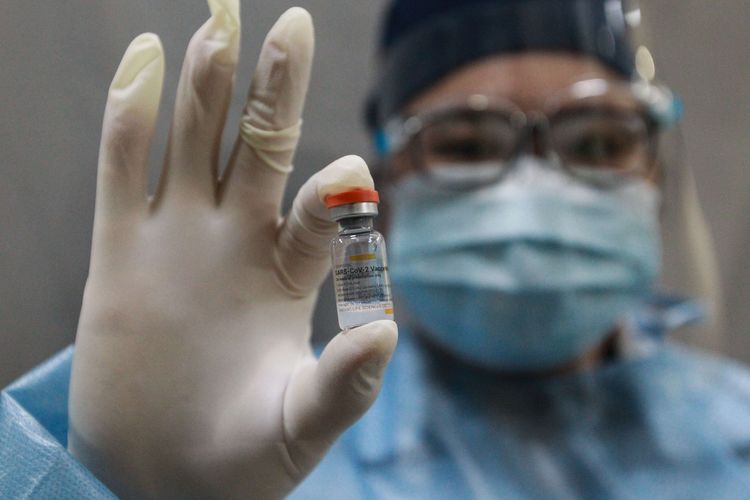 Tenaga kesehatan menunjukkan vaksin Sinovac Covid-19 saat pelaksanaan vaksin untuk tenaga medis di RS Siloam Kebon Jeruk, Jakarta, Kamis (14/1/20210). Vaksinasi tahap awal akan menargetkan 1,48 juta tenaga kesehatan yang dijadwalkan berlangsung dari Januari hingga Februari 2021.
Tenaga kesehatan menunjukkan vaksin Sinovac Covid-19 saat pelaksanaan vaksin untuk tenaga medis di RS Siloam Kebon Jeruk, Jakarta, Kamis (14/1/20210). Vaksinasi tahap awal akan menargetkan 1,48 juta tenaga kesehatan yang dijadwalkan berlangsung dari Januari hingga Februari 2021.Penerbitan EUA diberikan dengan mempertimbangkan kemanfaatan dan keselamatan pasien berdasarkan bukti ilmiah hasil uji klinik yang menunjukkan bahwa obat memiliki potensi khasiat dan keamanan, tetapi memiliki keterbatasan data, misalnya dalam hal kecukupan jumlah subjek dan periode pemantauan uji klinik terbatas serta kemungkinan data stabilitas yan masih perlu dilengkapi sedangkan untuk mendapat izin edar hal-hal tersebut harus dipenuhi.
Adapun EUA diberikan untuk obat yang memenuhi kriteria berikut ini:
- Telah ditetapkan keadaan kedaruratan kesehatan masyarakat oleh pemerintah
- Terdapat cukup bukti ilmiah terkait aspek keamanan dan khasiat dari obat untuk mencegah, mendiagnosis, atau mengobati penyakit/keadaan yang serius dan mengancam jiwa berdasarkan data non-klinik, klinik dan pedoman penatalaksanaan penyakit terkait
- Memiliki mutu yang memenuhi standar yang berlaku serta dan Cara Pembuatan Obat yang Baik
- Memiliki kemanfaatan lebih besar dari risiko, didasarkan pada kajian data non-klinik dan klinik obat untuk indikasi yag diajukan
- Belum ada alternatif pengobatan / penatalaksanaan yang memadai dan disetujui untuk diagnosa, pencegahan atau pengobatan penyakit penyebab kondisi kedaruratan kesehatan masyarakat.
Baca juga: Melihat Perbedaan Vaksin Buatan AS dengan Vaksin Buatan China, Ini Rinciannya...
Adapun obat yang dapat diajukan untuk mendapatkan EUA yakni obat yang termasuk produk biologi yang dibutuhkan untuk kondisi kedaruratan kesehatan masyarakat
Selain itu obat terdaftar dengan indikasi dan atau posologi baru untuk kondisi kedaruratan kesehatan masyarakat.
Baca juga: Jalan Panjang Wisma Atlet Kemayoran Sebelum Disulap Jadi RS Darurat Covid-19
Sampai kapan izin darurat berlaku?
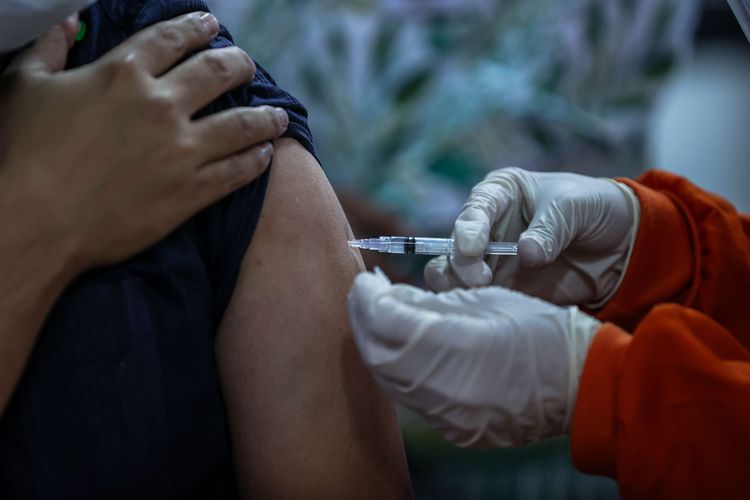 Petugas kesehatan menerima suntikan vaksin corona buatan Sinovac di Puskesmas Kecamatan Cilandak, Jakarta Selatan, Kamis (14/1/2021). Vaksin Sinovac telah mendapatkan izin penggunaan darurat atau emergency use authorization (EUA) dari Badan Pengawas Obat dan Makanan (BPOM). Dengan izin penggunaan darurat ini, vaksin CoronaVac produksi Sinovac Life Science Co.Ltd.China dan PT Bio Farma (Persero) dapat digunakan untuk program vaksinasi di Indonesia.
Petugas kesehatan menerima suntikan vaksin corona buatan Sinovac di Puskesmas Kecamatan Cilandak, Jakarta Selatan, Kamis (14/1/2021). Vaksin Sinovac telah mendapatkan izin penggunaan darurat atau emergency use authorization (EUA) dari Badan Pengawas Obat dan Makanan (BPOM). Dengan izin penggunaan darurat ini, vaksin CoronaVac produksi Sinovac Life Science Co.Ltd.China dan PT Bio Farma (Persero) dapat digunakan untuk program vaksinasi di Indonesia.Masih mengutip surat keputusan tersebut, persetujuan EUA hanya berlaku hingga masa kondisi kedaruratan kesehatan masyarakat dinyatakan berakhir oleh pemerintah dan selanjutnya akan ditinjau kembali sesuai perkembangan dan kondisi terkini.
Evaluasi terhadap EUA dilakukan oleh BPOM bersama tim Komite Nasional (Komnas) Penilai Obat dengan melibatkan ahli klinis terkait.
Dalam Keputusan tersebut juga dijelaskan,…
-
![]()
BLT Ibu Hamil dan Anak Usia Dini Rp 3 Juta Disalurkan 4 Kali, Kapan Saja?
-
![]()
WHO Peringatkan Tahun Kedua Pandemi Mungkin Lebih Sulit, Apa Sebabnya?
-
![]()
Hari Keenam, Berikut Update Perkembangan Pencarian Pesawat Sriwijaya Air SJ 182...
-
![]()
Raffi Ahmad, Elvis Presley, dan Kampanye Vaksinasi...
-
![]()
Masa Sanggah Sekolah untuk SNMPTN 2021 Diperpanjang, Ini Imbauan LTMPT






























![[POPULER TREN] Sorotan Media Asing terhadap Kekalahan Indonesia Lawan Uzbekistan | Profil Shen Yinhao, Wasit yang Picu Kontroversi](https://asset.kompas.com/crops/3MrbOE76DVhEY2aUbbk61E57lqA=/0x0:677x451/170x113/data/photo/2024/04/30/6631062f41daf.jpg)





![[POPULER TREN] Pabrik Sepatu Bata Purwakarta Tutup | Cara Nonton Indonesia Vs Guinea](https://asset.kompas.com/crops/gwDaIMCZh6kgXAvM2c6Ae0UoCls=/190x359:904x835/177x117/data/photo/2024/05/06/6637c8d7b435b.png)


















![[HOAKS] Cairan yang Disuntikkan kepada Presiden Jokowi Bukan Vaksin, tetapi Vitamin atau Air Tajin](https://asset.kompas.com/crops/W3EEHbcHKBRGxgMumb0MMtmpybI=/0x320:2000x1654/95x95/data/photo/2019/08/17/5d57b8fbcb3bb.jpg)






