Rumus Pengenceran Larutan beserta Contoh Soal dan Pembahasannya

KOMPAS.com - Anda mungkin pernah mendengar istilah pengenceran pada makanan atau minuman, yaitu menambahkan zat cair pada makanan dan minuman yang akan diencerkan.
Dilansir dari buku Kimia untuk SMA/MA (2010) oleh Suyatno, istilah pengenceran pada pembahasan ini, yaitu menambahkan pelarut berupa akuades untuk memperkecil konsentrasi larutan.
Volume larutan akan bertambah pada proses pengenceran, tetapi banyaknya zat terlarut tidak berubah.
Jika volume sebelum diencerkan sebesar V1 liter dan konsentrasi larutan sebanyak M1 molar maka jumlah mol zat terlarut sebesar V1.M1.
Setelah diencerkan, volumenya menjadi V2 liter, konsentrasi larutan M2 molar, dan mol zat terlarut = V2.M2 mol.
Baca juga: Jenis Reaksi Kimia dalam Larutan Elektrolit
Rumus pengenceran larutan
Dikutip dari buku Rumus Lengkap Kimia SMA (2008) oleh Anwar Santoso, karena mol zat terlarut pada pengenceran tidak berubah, maka berlaku:
"Mol zat terlarut sebelum pengenceran = mol zat terlarut sesudah pengenceran."
V1.M1 = V2.M2 atau 
Keterangan:
V1 = volume sebelum pengenceran
M1 = molaritas sebelum pengenceran
V2 = volume sesudah pengenceran
M2 = molaritas sesudah pengenceran
Baca juga: Definisi Larutan Penyangga, Jenis, dan Contohnya
Sementara itu, jika dilakukan pencampuran, maka berlaku rumus:
M campuran = 
Keterangan:
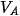 = volume zat A
= volume zat A = volume zat B
= volume zat B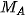 = molaritas zat A
= molaritas zat A = molaritas zat B
= molaritas zat B
Baca juga: Cara Membuat Larutan Penyangga
Contoh soal 1
NaOH sebanyak 10 gram dilarutkan dalam air sehingga diperoleh 500 ml larutan NaOH (Mr = 40). Hitung kemolaran larutan tersebut!
Jawab:
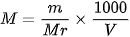
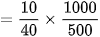
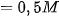
Baca juga: Ciri-ciri Larutan Basa
Contoh soal 2
Jika 20 ml HCl 5 M diencerkan menjadi 0,4 M. Berapa jumlah air yang harus ditambahkan pada larutan?
Jawab:
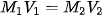
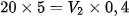
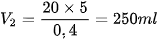
Baca juga: Kelompok Larutan Elektrolit Berupa Senyawa Ion
Contoh soal 3
Jika 7 liter HCl 0,3 M dicampurkan dengan 500 ml HCl 0,2 M. Berapa konsentrasi larutan HCl yang diperoleh?
Jawab:
M campuran = 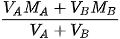
M campuran = 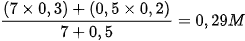
Baca juga: Larutan Non Elektrolit: Pengertian dan Contohnya
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.




















































![[POPULER GLOBAL] Arab Saudi Setop Keluarkan Izin Umrah | Cerita Ayah Tak Mampu Beli iPhone bagi Putrinya](https://asset.kompas.com/crops/03TTcA2XUDNdWG0C1dXVVMZMsxU=/95x0:939x563/300x200/data/photo/2023/12/09/6574041baa0bb.jpg)











