Konfigurasi Elektron: Prinsip Aufbau, Larangan Pauli, dan Aturan Hund

KOMPAS.com - Model atom mekanika kuantum menyatakan bahwa elektron berada pada orbital-orbital atom.
Atom-atom tersebut menempati orbital sesuai dengan susunannya, atau yang disebut sebagai konfigurasi elektron.
Aturan dalam konfigurasi elektron terdiri dari tiga yakni Prinsip Aufbau, Aturan Hund, dan Larangan Pauli.
Prinsip Aufbau
Dilansir dari Encyclopaedia Britannica, Prinsip Aufbau dikemukaan oleh fisikawan Denmark bernama Niels Bohr pada tahun 1920.
Baca juga: Model Atom Bohr
Prinsip Aufbau menyatakan bahwa pada kondisi dasar, elektron akan menempati kulit elektron dengan energi yang lebih rendah menuju energi yang lebih tinggi. Prinsip Aufbau digambarkan dalam diagram berikut:
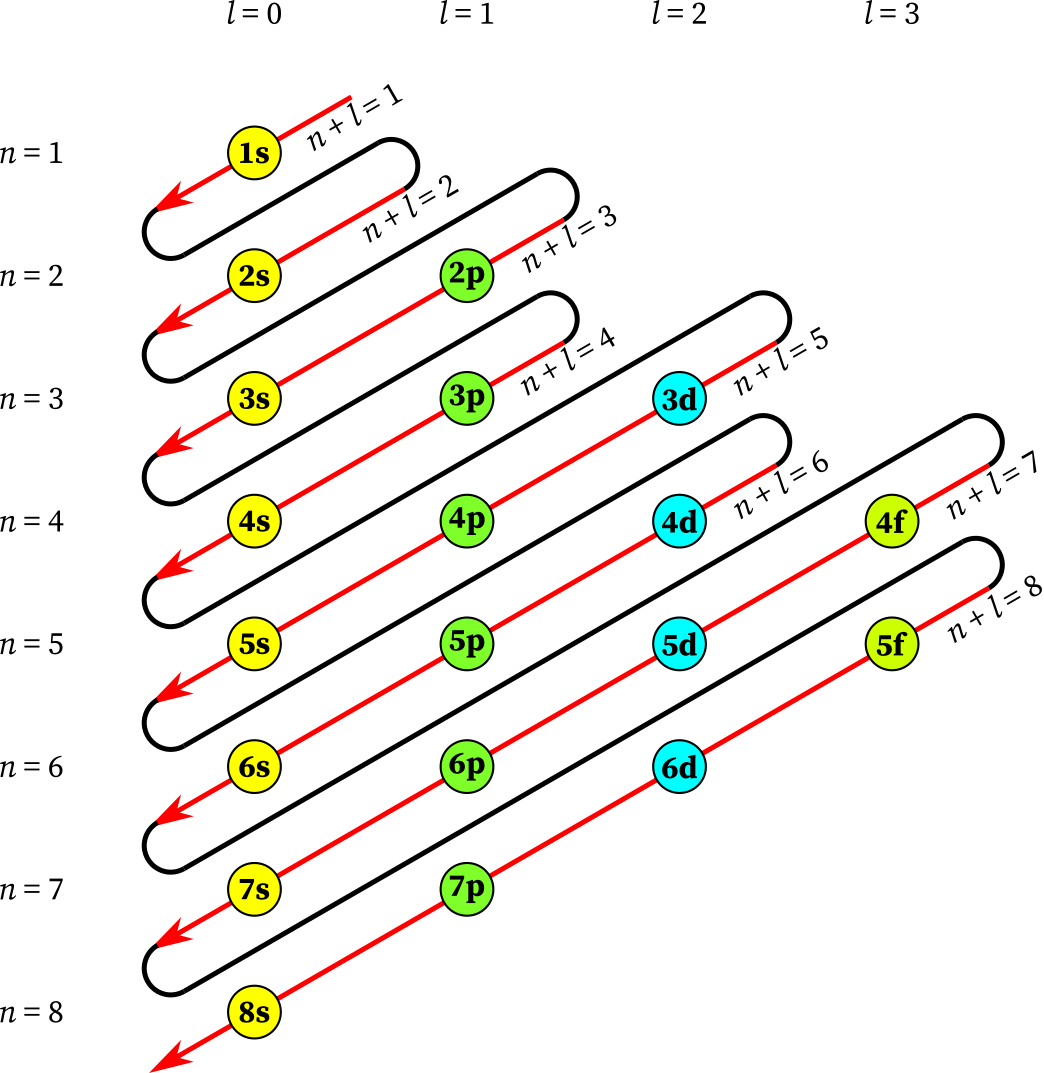 aturan Aufbauf
aturan Aufbauf
Pada gambar terlihat bahwa konfigurasi elektron dengan Prinsip Aufbau bergantung pada penjumlahan bilangan kuantum utama (n) dan bilangan kuantum azimuth (l).
Urutan energi orbital atom dari yang paling rendah ke yang paling tinggi adalah 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, dan seterusnya.
Maka elektron akan menempati sub kulit 1s terlebih dahulu baru menempati sub kulit 2s.
Pada subkulit s hanya dapat ditempati oleh 2 elektron. Pada subkulit p hanya dapat ditempati 6 elektron. Pada sub kulit d hanya dapat ditempati 10 elektron, dan pada kulit f hanya dapat ditempati 14 elektron.
Baca juga: Model Atom Mekanika Kuantum