KOMPAS.com - Berikut soal UAS dan pembahasan prinsip molalitas dan molaritas.
Soal1: 3,45 gram urea dilarutkan dalam 250 gram air. Tentukanlah molalitas larutan urea tersebut!
Jawaban:
Pertama-tama tentukan masaa molekul relatif dari urea atau Co(NH2)2:
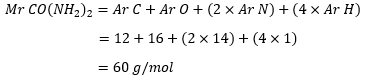 Perhitungan Mr urea
Perhitungan Mr urea
Hitung molalitas larutan urea menggunakan persamaan molalitas:
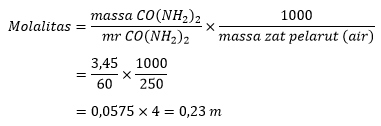 Perhitungan molalitas urea
Perhitungan molalitas urea
Jadi, molalitas larutan urea tersebut adalah 0,23 m.
Baca juga: Perbedaan Perubahan Kimia dan Fisika
Soal 2: Pada suatu botol terturlis larutan asam sulfat pekat 96% dengan massa jenis 1,8 kg/L. Tentukanlah molaritas larutan H2SO4 tersebut!
Jawaban:
Larutan asam sulfat 96% berarti larutan tersebut mengandung 96% asam sulfat atau H2SO4 dan 2% air
Tentukanlah massa molekul realtif H2SO4:
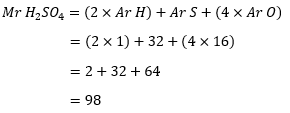 Perhitungan Mr asam sulfat
Perhitungan Mr asam sulfat
Tentukan molaritas asam sulfat pekat tersebut menggunakan rumus molaritas:
 Perhitungan molaritas asam sulfat
Perhitungan molaritas asam sulfat
Jadi, molaritas asam sufat pekat 98% adalah 17,632 M.
Baca juga: Penentuan Kadar Unsur Kimia dalam Suatu Produk
Soal 3: Suatu larutan memiliki massa jenis larutan 1,2 g/mL dengan volume 500 mL dan mengandung 5% H2SO4. Tentukan berapa molalitas H2SO4 dalam larutan tersebut!
Jawaban:
- Pertama-tama tentukan massa molekul relatif H2SO4:
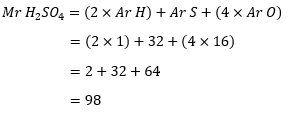 Perhitungan Mr asam sulfat
Perhitungan Mr asam sulfat
- Tentukan massa total larutan:
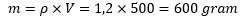 Perhitungan massa larutan
Perhitungan massa larutan
Tentukan massa H2SO4 dalam larutan tersebut:
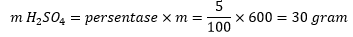 Perhitungan massa asam sulfat
Perhitungan massa asam sulfat
Maka, massa zat pelarut = massa total larutan – massa terlarut = 600 – 30 = 570 mL.
Mencari molalitas H2So4 dengan persamaan molalitas larutan:
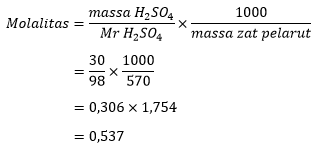 Perhitungan molalitas asam sulfat
Perhitungan molalitas asam sulfat
Maka, molalitas 5% H2SO4 dalam pelarut 500 mL adalah 0,537 m.
Baca juga: Kegunaan dan Pembuatan Unsur Kimia dan Senyawanya
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.