Pengertian, Prinsip Kerja dan Stoikiometri Sel Elektrolisis

KOMPAS.com - Sel elektrolisis merupakan salah satu sel elektrokimia selain sel volta. Apakah sel elektrolisis juga menghasilkan listrik seperti sel volta? mari simak penjelasan dibawah ini!
Pengertian Sel Elektrolisis
Dilansir dari Chemistry LibreTexts, jika sel volta adalah sel elektrokimia yang mampu mengubah energi kimia menjadi listrik, sel elektrolisis adalah kebalikannya yaitu merubah energi listrik menjadi energi kimia.
Sel elektrolisis menggunakan energi listrik untuk menghasilkan reaksi redoks.
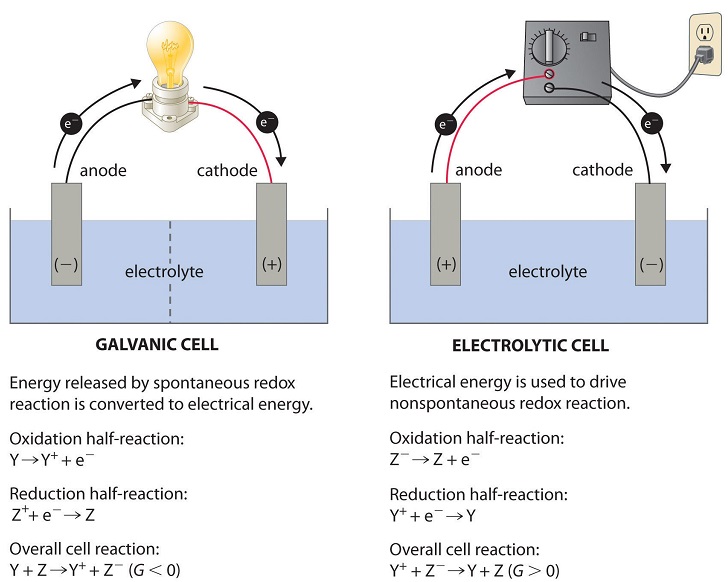 Sel Elektrolisis
Sel Elektrolisis
Prinsip Kerja Sel Elektrolis
Dilansir dari Encyclopaedia Britannica, sel elektrolisis memiliki dua elektroda yang bersifat negative dan positif dan dicelupkan kedalam larutan elektrolit yang mengandung ion-ion bermuatan. Kedua elektroda tersebut berada dalam wadah dan larutan elektrolit yang sama.
Baca juga: Pengertian dan Prinsip Kerja Sel Volta
Saat sel elektrolisis dialiri dengan listrik, muatan listrik yaitu elektron akan memicu reaksi redoks pada sel. Anoda akan mengalami reaksi oksidasi dan katoda akan mengalami reaksi reduksi.
Jika sel elektrolisis memiliki elektroda platina (Pt) dengan cairan elektrolit CuCl2, maka akan terjadi elektrolisis. Pada katoda akan terjadi reaksi:
 Reaksi pada katoda
Reaksi pada katoda
Cu2+ adalah ion logam yang mengalami reduksi atau pengikatan elektron dan menghasilkan logam Cu sebagai produk. Pada anoda, ion-ion klorin (Cl-) akan mengalami oksidasi dengan persamaan sebagai berikut:
 Reaksi pada anoda
Reaksi pada anoda
 Ilustrasi reaksi kimia.
Ilustrasi reaksi kimia.Ion-ion Cl akan melepaskan kelebihan elektron yang dimilikinya dan berubah menjadi gas klorin sebagai produknya. Sel elektrilisis ini menghasilkan reaksi redoks untuk menghasilkan gas klorin sebagai berikut:
Baca juga: Ilmuwan Peringatkan Embusan Rokok Elektrik Mengandung Zat Berbahaya
Stoikiometri Sel Elektrolisis
Reaksi redoks pembentukan gas klorin memiliki produk lain yaitu enpadan tembaga (Cu).
Dilansir dari Chemical LibreTexts, hukum Faraday menjelaskan bahwa jumlah endapan yang dihasilkan sel elektrolisis akan berbanding lurus dengan besarnya muatan listrik yang diberikan.
Banyaknya endapan logam yang dihasilkan sel elektrolisis dapat dihitung dengan persamaan:
 Persamaan Faraday
Persamaan Faraday
w = massa endapan (g)
e = masa ekuivalen
I = kuat arus elektrolisis (A)
F = tetapan Faraday
Baca juga: Mengenal 2 Ilmuwan Perempuan Peraih Nobel Kimia 2020
- Misalkan reaksi redoks pembentukan gas klorin dapat terjadi karena dialiri arus litrik sebesar 2 ampere selama 10 menit, berapakah massa endapan tembaga yang terbentuk?
Pertama, carilah massa ekuivalen dari logam Cu dari massa atom relative (Ar) dan bilangan oksidasi (biloks) Cu:
 Rumus massa ekuivalen atom
Rumus massa ekuivalen atom
Masukan kedalam persamaan hukum Faraday:
 Perhitungan massa endapan Cu
Perhitungan massa endapan Cu
Maka, endapan Cu yang terbentuk dari el elektrolisis tersebut adalah sebanyak 0,34 gram.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.
-
![]()
Solusi Internet of Things untuk Mengelola Listrik dengan Cerdas, Aman, dan Efisien
-
![]()
Sifat Kimia: Pengertian dan Ciri-ciri
-
![]()
Perbedaan Listrik Statis dan Listrik Dinamis
-
![]()
Peranan Ilmu Kimia dalam Menyelesaikan Masalah Global
-
![]()
Potensial Listrik, Jawaban Soal TVRI 1 Oktober SMP
-
![]()
Perubahan Entalpi pada Reaksi Kimia



































































