Sifat Periodik Unsur

KOMPAS.com – Unsur yang ada di bumi memiliki sifat periodik. Misalnya, jika nomor atom dalam satu golongan makin kecil. Maka, yang bertambah besar adalah energi ionisasi, afinitas elektron, dan kelektronegatifannya.
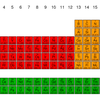
Tabel periodik menyusun unsur-unsur sesuai dengan sifat periodiknya. Apa saja sifat periodik unsur? Sifat periodik unsur adalah sebagai berikut:
- Jari-jari atom
- Energi ionisasi
- Afinitas elektron
- Keelektronegatifan
- Sifat kelogaman
Baca juga: Tabel Periodik
Jari-jari atom
Sifat periodik unsur yang pertama adalah jari-jari atom. Jari-jari atom jarak antara elektron terluar dengan inti atom.
Namun, karena posisi atom tidak bisa ditentukan secara pasti seperti dalam ketidakpastian Heisenberg.
Maka sebagaimana dilansir dari Chemistry LibreTexts, jari-jari atom didefinisikan sebagai jarak antara dua inti atom yang identik.
Dalam suatu golongan, jari-jari atom makin besar dari atas ke bawah. Hal tersebut karena makin banyaknya kulit elektron dari atas ke bawah.
Adapun, dalam periode jari-jari atom makin kecil dari kiri ke kanan. Hal tersebut dikarenakan muatan inti atom yang makin banyak, tetapi jumlah kulit elektron tetap. Sehingga, memberikan gaya tarik inti lebih kuat yang memperkecil jari-jari atom.
Baca juga: Dasar Teori dan Model Atom Mekanika Kuantum
Energi ionisasi
Sifat periodik unsur selanjutnya adalah energi ionisasi. Energi ionisasi adalah jumlah energi yang dibutuhkan untuk melepaskan suatu elektron dalam atom.
Dalam tabel periodik, energi ionisasi unsur meningkat dari bawah ke atas. Hal tersebut dikarenakan makin sedikit elektron, maka makin kuat ikatannya. Sehingga, memerlukan energi ionisasi yang besar untuk melepaskan elektronnya.
Adapun, energi ionisasi meningkat dari kiri ke kanan. Hal tersebut dikarenakan makin kuat muatan intinya, maka makin besar energi ionisasi yang dibutuhkan untuk melepaskan elektron dari intinya.
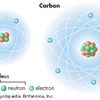
Unsur yang memiliki energi ionisasi terbesar adalah helium. Energi ionisasi terbesar dimiliki oleh helium karena elektron helium sangat dekat dengan intinya (nukleus) daripada unsur lain dalam tabel periodik.
Baca juga: Cara Membaca Sistem Periodik Unsur
Hal tersebut membuat gaya elektrostatis yang besar, sehingga elektron terikat dengan sangat kuat ke inti atomnya.
Sehingga, memerlukan energi ionisasi yang sangat besar untuk melepaskan elektron tersebut dari inti hidrogen.
Afinitas elektron
Dilansir dari Encyclopedia Britannica, afinitas elektron adalah jumlah energi yang dibebaskan ketika sebuah elektron ditambahkan ke atom netral untuk membentuk ion bermuatan negatif. Sederhananya, afinitas elektron adalah energi yang dikeluarkan atom untuk menerima satu elektron.
Dalam tabel periodik, dari atas ke bawah akan menjadi kurang negatif. Sedangkan dari kiri ke kanan akan menjadi makin negatif.
KeelektronegatifanSifat periodik unsur selanjutnya adalah…
-
![]()
Tabel Periodik
-
![]()
Cara Membaca Sistem Periodik Unsur
-
![]()
Soal UAS Kimia: Struktur Atom Berdasarkan Tabel Periodik
-
![]()
Orbital Atom: Ruang Ditemukannya Elektron
-
![]()
Partikel-Partikel Penyusun Atom: Proton, Elektron, Neutron
-
![]()
Dampak Benda Kelebihan Atau Kekurangan Elektron
-
![]()
Konfigurasi Elektron: Prinsip Aufbau, Larangan Pauli, dan Aturan Hund