
KOMPAS.com - Dalam Soal UAS kimia kelas 11 seringkali dijumpai permasalahan tentang penyetaraan bilangan oksidasi. Juga seringkali dijumpai tentang permasalahan penentuan oksidator pada reaksi.
Berikut ulasan dan pembahasan soal UAS kimia kelas 11 yang telah dirangkum secara sederhana:
1. Tentukan bilangan oksidasi unsur P dalam senyawa H3PO4!
Jawaban:
- Tentukan biloks senyawa H3PO4:
Menurut aturan biloks, suatu senyawa ataupun molekul memiliki jumlah bilangan oksidasi sama dengan nol. Hal ini berarti jumlah bilangan oksidasi senyawa H3PO4 adalah nol.
- Tentukan biloks unsur-unsur penyusun senyawa H3PO4:
Dilansir dari Chemistry LibreTexts, unsur hidrogen (H) selalu memiliki bilangan oksidasi +1 kecuali pada hibrida logam seperti senyawa NaH yang mempunyai biloks -1.
Bilangan oksidasi unsur Oksigen (O) selalu bernilai -2 kecuali pada peroksida yang bernilai -1, dan pada senyawa biner fluor yang bernilai +2.
Maka dapat dihitung biloks unsur P sebagai berikut:
 Perhitungan bilangan oksidasi P
Perhitungan bilangan oksidasi P
Maka, didapatkan bahwa bilangan unsur P dalam senyawa H3PO4 adalah +5.
Baca juga: Pengertian dan Cara Menyetarakan Reaksi Redoks
 Ilustrasi Reaksi Oksidasi Reduksi dan Konsep Redoks
Ilustrasi Reaksi Oksidasi Reduksi dan Konsep Redoks2. Pada reaksi redoks MnO2 dan 4 HCl, tentukan mana yang merupakan oksidator!
 Persamaan reaksi redoks
Persamaan reaksi redoks
Jawaban:
Tentukan biloks unsur-unsur yang terlibat dalam reaksi untuk mengetahui mana yang merupakan reaksi oskidasi, dan mana yang merupakan reaksi reduksi.
- Tentukan biloks unsur Mn pada senyawa MnO2, dengan biloks oksigennya adalah -2 dan jumlah biloks senyawa MnO2 adalah 0:
 Perhitungan biloks Mn sebelum reaksi
Perhitungan biloks Mn sebelum reaksi
Tentukan biloks unsur Cl pada senyawa HCl, dengan biloks hidrogen adalah +1 dan jumlah biloks dalam senyawa HCl adalah 0.
HCl hanya terdiri dari dua unsur yaitu unsur H dan unsur Cl. Jika biloks unsur H adalah +1, maka biloks unsur Cl haruslah -1 agar jumlah keseluruhannya sama dengan nol.
- Tentukan biloks Mn pada senyawa MnCl2, dengan biloks Cl selalu -1 kecuali saat sedang berikatan dengan unsur F atau O.
Baca juga: Reaksi Oksidasi Reduksi dan Konsep Redoks
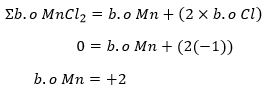 Perhitungan biloks Mn setelah reaksi
Perhitungan biloks Mn setelah reaksi
Unsur Cl2 merupakan unsur bebas sehingga menurut aturan biloks, bilangan oksidasinya selalu nol.
-
 Biloks keseluruhan reaksi redoks
Biloks keseluruhan reaksi redoks
Perhatikanlah perubahan biloks unsur yang sama dikanan dan kiri reaksi. Unsur Mn mengalami penurunan biloks, pada awalnya Mn memiliki biloks +4 namun setelah reaksi biloksnya menjadi +2 karena mengalami reduksi.
Biloks unsur Cl sebelum reaksi adalah -1 dan setelah reaksi naik menjadi 0, hal ini karena unsur Cl mengalami oksidasi.
Unsur yang mengalami reduksi atau penurunan biloks disebut dengan oksidator, dalam reaksi ini adalah MnO2. Sedangkan unsur yang menglami oksidasi atau kenaikan biloks disebut dengan reduktor, dalam reaksi ini adalah MnCl2.
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.

































































