Cara Menentukan Rumus Molekul dalam Senyawa

KOMPAS.com - Suatu senyawa kimia pasti memiliki rumus molekul, yaitu rumus yang menyatakan jumlah atom-atom dalam senyawa tersebut secara rinci. Pada materi kali ini kita akan mempelajari cara untuk menemukan rumus molekul dari suatu campuran unsur.
Penentuan Rumus Molekul
Rumus molekul suatu senyawa kimia dapat didapatkan dari persentase atom-atom penyusunya dengan cara mengetahui rumus empirisnya.
Dilansir dari Encyclopaedia Britannica, rumus empiris adalah rasio perbandingan atom yang paling sederhana dalam suatu senyawa kimia. Dapat disimpulkan bahwa rumus empiris adalah penyederhanaan dari rumus molekul.
Baca juga: Guru Besar UGM: Ini 9 Senyawa Meningkatkan Sistem Imun saat Pandemi
Rumus empiris suatu molekul dapat ditentukan dengan cara mencari jumlah mol atom dengan massa molar, lalu menentukan rasio perbandingan mol atom-atom penyusun senyawanya.
Contoh soal penentuan rumus molekul:
- Misalkan suatu senyawa dengan massa molekul relatif sebesar 180,18 terdiri atas campuran 60% karbon, 6,72% hidrogen, dan 53,28% oksigen. Apakah rumus empiris dan rumus molekul senyawat tersebut jika Ar karbon adalah 12,01, Ar hidrogen adalah 1,008, dan Ar oksigen adalah 16?
Pembahasan:
Hal yang pertama kali dilakukan adalah menentukan berat atom-atom penyusun berdasarkan presentasenya. Karena persentase atom-atomnya berjumlah 100%, maka berat senyawa dapat dimisalkan menjadi 100 gram.
Jika jumlah senyawa adalah seberat 100 gram, maka berat karbon adalah 40 gram, berat atom hidrogen adalah 6,72 gram, dan berat atom oksigen adalah 58,28 gram. Setelah diketahui beratnnya, tentukanlah besar massa molar atom-atom tersebut:
Baca juga: Peneliti Gabungan IPB dan UI Temukan Senyawa Antivirus Corona
 Ilustrasi kesetimbangan kimia.
Ilustrasi kesetimbangan kimia.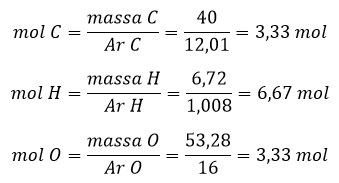 Perhitungan mol atom
Perhitungan mol atom
Tentukan rasio perbandingan antara mol atom C:H:O, yaitu 3,33:6,67:3,33. Jika perbandingan tersebut disederhanakan, maka didapat rasio 1:2:1 yang artinya 1 atom C, 2 atom H, dan 1 atom O.
Maka didapatkan rumus empiris senyawanya adalah CH2O. Senyawa CH2O memiliki massa molekul relatif sebesar:
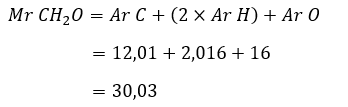 Perhitungan Mr rumus empiris
Perhitungan Mr rumus empiris
Baca juga: Tatanama Senyawa Kimia
Rumus molekul didaptkan dari perbandingan massa molekul relatif senyawa tersebut dengan Mr yang didapat dari rumus empiris:
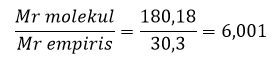 Rasio Mr empiris dan Mr molekul
Rasio Mr empiris dan Mr molekul
Nilai perbandingannya adalah 6,001 atau dapat dibulatkan menjadi 6. Nilai 6 dimasukan kedalam rumus empiris sebagai koefisien semua atom:
 Penentuan rumus molekul
Penentuan rumus molekul
Maka, rumus empiris senyawa tersebut adalah CH2O dengan rumus molekulnya adalah C6H12O6 atau yang biasa kita kenal sebagai gula sederhana atau monosakarida.
Baca juga: Dari Data Sinar-X, Ilmuwan Jelaskan Senyawa Alami ini Bunuh Nyamuk
Simak breaking news dan berita pilihan kami langsung di ponselmu. Pilih saluran andalanmu akses berita Kompas.com WhatsApp Channel : https://www.whatsapp.com/channel/0029VaFPbedBPzjZrk13HO3D. Pastikan kamu sudah install aplikasi WhatsApp ya.