Konfigurasi Elektron Gas Mulia
KOMPAS.com – Gas mulia adalah golongan VIIIA pada tabel periodik yang dijadikan patokan kestabilan unsur. Hal tersebut karena gas mulia memiliki konfigurasi elektron yang paling stabil.
Berikut adalah konfigurasi elektron unsur-unsur kelompok gas mulia sesuai dengan prinsip Aufbauf, aturan Hund, dan juga larangan Pauli!
Helium (He)
Helium (He) memiliki nomor atom 2, artinya helium hanya memiliki 2 elektron. Dilansir dari Chemistry LibreTexts, kedua elektron tersebut akan menduduki subkulit s dari kulit pertama yang paling dekat dengan nukleus dan memiliki energi elektron terendah.
Sehingga, konfigurasi elektron helium adalah:

Elektron helium memenuhi kulit pertama, sehingga elektron valensinya penuh. Hal tersebut membuat helium stabil, sehingga menjadi standar bagi aturan duplet (aturan kestabilan unsur).
Neon (Ne)
Neon (Ne) adalah gas mulia yang memiliki nomor atom 10. Artinya, neon memiliki 10 elektron dengan konfigurasi sebagai berikut:
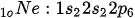
Dilansir dari Lumen Learning, kulit valensi neon adalah kulit 2 (termasuk subkulit s dan p) yang mengandung 8 elektron.
8 elektron mengisi penuh kulit valensi neon, sehingga neon menjadi unsur yang stabil. Hal ini menjadi dasar kestabilan unsur lain yang disebut dengan aturan oktet.
Argon (Ar)
Gas mulia selanjutnya adalah argon yang memiliki nomor atom 18. 18 elektron argon mengisi 3 kulit elektron dengan konfigurasi sebagai berikut:
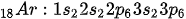
Terlihat di kulit valensi (kulit ketiga) terdapat 8 elektron yang lagi-lagi memenuhi aturan oktet.
Kripton (Kr)
Kripton adalah gas mulia yang memiliki nomor atom 36. 36 elektron kripton mengisi 4 kulit elektron dengan konfigurasi sebagai berikut:
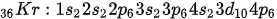
Pada konfigurasi tersebut, lagi-lagi terlihat bahwa elektron valensi berada di kulit keempat dengan jumlah 8 elektron.
Xenon (Xe)
Xenon adalah unsur gas mulia dengan nomor atom 54. Elektron milik xenon menempati hingga 5 kulit elektron dengan konfigurasi sebagai berikut:
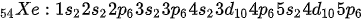
Sub kulit valensi xenon adalah 5s2 dan 5p6. Artinya, xenon memiliki 8 elektron valensi yang membuatnya stabil.
Radon (Rn)
Unsur gas mulia yang terakhir adalah radon. Radon memiliki nomor atom dan elektron sebanyak 86 buah. Konfigurasi elektron radon adalah:
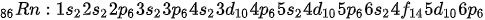
Subkulit valensi radon adalah 6s2 dan 6p8. Artinya, radon memiliki 8 elektron valensi yang juga sesuai dengan aturan oktet kestabilan atom.
Dari konfigurasi elektron gas mulia di atas didapatkan bahwa semua unsur gas mulia (kecuali helium) memiliki elektron valensi 8 yang menjadi patokan aturan oktet kestabilan atom.
https://www.kompas.com/skola/read/2022/04/26/165648969/konfigurasi-elektron-gas-mulia