Tekanan Osmotik: Pengertian dan Contoh Soalnya
KOMPAS.com – Larutan merupakan zat cair yang memiliki zat terlarut di dalamnya. Zat terlarut tersebut menghasilkan sifat koligatif larutan, salah satunya adalah tekanan osmotik. Apa yang dimaksud dengan tekanan osmotik?
Pengertian tekanan osmotik
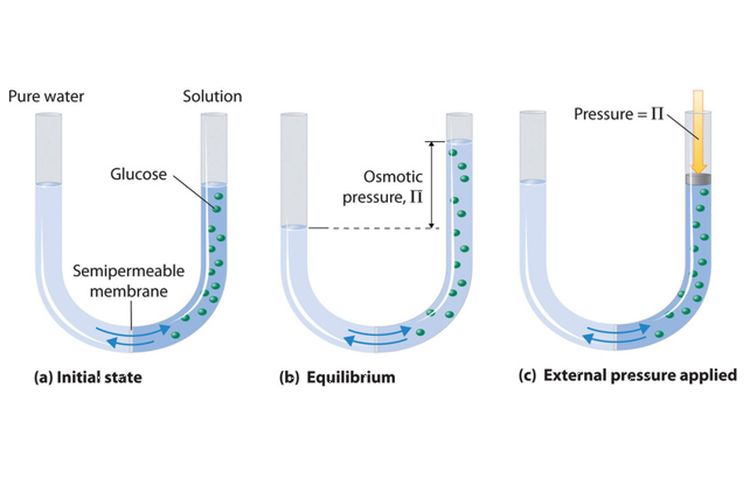
Tekanan osmotik adalah tekanan yang melawan terjadinya osmosis pada larutan. Dilansir dari Lumen Learning , osmosis adalah aliran molekul pelarut melalui membran semipermeabel dari daerah dengan konsentrasi rendah ke konsentrasi tinggi.
Osmosis membuat larutan hipotonik (sedikit zat terlarut) berpindah (berdifusi) ke dalam larutan hipertonik (banyak zat terlarut) agar mencapai keseimbangan konsentrasi (isotonik). Udara akan terus berdifusi ke konsentrasi yang lebih tinggi, hingga konsentrasi ke dua larutan tersebut adalah sama.
Osmosis hal yang selalu diinginkan. Misalnya, sel-sel tubuh kita terdiri dari air. Osmosis akan membuat cairan masuk ke dalam sel dan mengatasinya, sehingga menyebabkan sel. Atau sebaliknya, osmosis menyebabkan cairan ke luar dari sel, sehingga sel mengalami dehidrasi.
Baca juga: Sifat Koligatif Larutan Elektrolit dan Faktor Vant Hoff
Baik kekeringan maupun dehidrasi, keduanya adalah hal yang merusak dan berakibat fatal bagi tubuh. Sehingga osmosis harus dihentikan. Pada saat inilah tekanan osmotik diperlukan untuk mencegah terjadinya osmosis dan mempertahanan keseimbangan osmotik.
Tekanan osmotik terbentuk pada larutan dengan konsentrasi tinggi atau hipertonik (memiliki banyak zat terlarut) untuk mencegah osmosis yang terjadi.
Dilaporkan dari Chemistry LibreTexts , tekanan osmotik didasarkan pada zat terlarut dan mengikuti hukum yang menyerupai persamaan gas ideal sebagai berikut:
= (nRT)/V = MRT
= tekanan osmotik (Pa atau atm)
n = mol zat terlarut (mol)
R = konstanta gas ideal 0,082 L atm/mol K
T = suhu mutlak (K)
M = molaritas larutan atau jumlah mol zat terlarut per satuan volume (mol/ L)
Baca juga: Jenis Koloid, Sifat, dan Contohnya
Contoh soal tekanan osmotik
Contoh soal 1
hitunglah tekanan osmotik larutan 3.6 gram glukosa yang terlarut dalam 500 mL larutan pada suhu 27 derajat celcius! (Mr = 180, R = 0,082 L atm/mol K)
Jawaban:
Tentang mengetahui suhu dalam derajat celcius, sehingga kita harus mengubahnya menjadi kelvin (K) sebagai berikut:
T = 27°C
= 27°C + 273 = 300 K
Untuk mengetahui jawabannya, terlebih dahulu harus mencari molaritasnya (M) terlebih dahulu dengan persaman sebagai berikut:


































































